人类等多细胞生物拥有几百种功能各异的细胞类型,这些细胞共同构建了一个完整的生命体。所有这些多样化的细胞类型都源自同一受精卵,经过细胞分裂和细胞分化过程演变而来,它们携带着相同的DNA遗传信息,其在基因表达图谱、细胞性状和功能上的差异主要归因于表观遗传信息(epigenetic information)。表观遗传信息如同生命的调色板,决定了细胞独特的身份。染色质是DNA遗传信息和表观遗传信息的共同载体。其基本构建模块是核小体(nucleosome),由~147 bp的DNA紧密缠绕在组蛋白八聚体上构成,包含一个(H3-H4)2四聚体和两个H2A-H2B二聚体。核小体进一步组织、折叠形成染色质的高级结构。
核小体携带的多种组蛋白翻译后修饰(posttranslational modifications,PTMs),是表观遗传标记(epigenetic marks)的关键组成部分【1】。这些标记在细胞分裂时弹性地从亲代细胞传递到子代细胞,不仅维持了表观遗传记忆,还为细胞分化提供表观信息改写的必要窗口。这种表观遗传标记的传递机制是通过DNA复制过程中亲代核小体的解组装和新生链核小体的重新组装实现的【2-4】。随着DNA复制叉的推进,它首先解组装前方亲代核小体,以便复制体可以接触DNA,进而打开双链DNA(dsDNA)进行DNA复制。此过程中,组蛋白分子伴侣和复制体组成因子回收解离的携带着表观遗传标记的亲代组蛋白,并将其重新分配至两条新生的子链DNA上,完成新生核小体的组装,从而实现表观遗传信息的传递【3】。如果这一过程中表观遗传信息传递出现紊乱,可能会导致染色质结构和基因表达图谱的改变,进一步引发细胞类型的变异,甚至可能导致癌症、衰老等疾病或人体代谢异常的发生。
DNA复制的分子机器---复制体(replisome),其核心组成为复制解旋酶CMG,该酶由Mcm2-7六聚体、Cdc45和GINS共同构成。此外,众多其他复制因子直接或间接地组装在复制体上,包括前导链聚合酶Pol ε、滞后链聚合酶Pol δ、引物酶Pol α、Ctf4等。此外,复制叉保护复合物(fork protection complex,FPC)和核小体分子伴侣FACT是染色质环境下DNA复制的必需因子,保障了DNA复制的正常进行。在DNA复制偶联的核小体代谢过程中,FACT不仅在新合成组蛋白呈递中发挥功能【5,6】;也参与复制叉前端核小体解组装和亲本组蛋白的回收过程【7-9】,但是其分子机制尚不清楚。
以往的研究表明,多个复制体因子具有组蛋白分子伴侣活性,并参与组蛋白到新生链的转运和分配。例如,Mcm2亚基的N末端延伸结构域(N-terminal extension,NTE)中含有一段保守的组蛋白结合结构域(histone binding domain,HBD),能够以模拟DNA结合的方式缠绕组蛋白(H3-H4)2四聚体并促进其分配至新生DNA滞后链【10,11】。
尽管已经知道组蛋白分子伴侣和复制体因子参与亲代组蛋白回收,但在染色质复制过程中,它们如何促进与DNA复制偶联的亲代核小体的解组装和随后的亲代组蛋白传递到新生DNA链上的分子机制仍不清楚。目前,复制体协同FACT回收组蛋白的复合物的结构研究非常缺乏,极大地限制了我们对染色质复制机制的全面理解。
2024年3月6日,香港大学翟元梁教授、北京大学高宁教授、北京大学李晴教授、康奈尔大学戴碧瓘教授合作,在Nature杂志发表题为“Parental histone transfer caught at the replication fork”的研究论文。该工作捕捉到了DNA复制偶联的核小体解组装和组蛋白回收过程中的一个关键中间复合物——FACT-histones-Replisome复合物并进行了结构和机制的解析,阐释了亲代组蛋白回收的关键分子机制。

该工作起始于2015年,研究人员通过整合亲和纯化标签、细胞周期同步、染色质富集、梯度交联等大分子复合物纯化技术,以及经过大量的条件优化,成功从大规模培养的酿酒酵母细胞中纯化出内源的复制体复合物。经过精细的冷冻电镜结构分析,捕捉到了结合有FACT和亲代组蛋白的复制体复合物并获得了其3.5埃的高分辨冷冻电镜结构(图1)。与结构数据一致的是,定量质谱结果显示histones、FACT同其它复制体组件类似都具有很高的丰度。
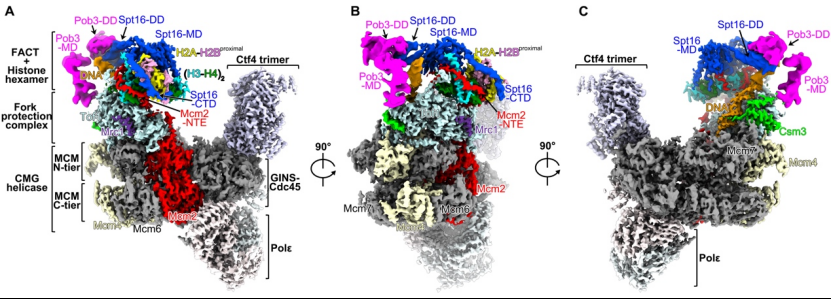
图1,Replisome-FACT-histones复合物冷冻电镜结构(A-C)。
在该复制体结构中,组蛋白以六聚体形式存在,包含1个(H3-H4)2四聚体和1个H2A-H2B二聚体。亲本DNA完全从组蛋白上剥离,另外一个H2A-H2B二聚体也已解离(图2)。Tof1的一段helix-turn-helix插入到亲本dsDNA和组蛋白六聚体之间,确保DNA的完全剥离。FACT利用Spt16的中间结构域(MD)和羧基端结构域(CTD),与Mcm2-HBD一起,占据了组蛋白六聚体上亲本DNA和H2A-H2B二聚体解离后暴露出的结合表面(图2)。其中,Mcm2-HBD的一段长Helix占据了已解离H2A-H2B的结合界面,同时通过一段loop区域缠绕在其中一个H3-H4二聚体上暴露出的DNA结合界面上(图2D,2F)。有意思的是,另一个H3-H4二聚体的DNA结合界面完全暴露,这可能为组蛋白回收通路下游因子的结合留出空间(图2D)。Spt16-CTD尾部的一段loop区域结合在H2A-H2B二聚体暴露出的DNA结合界面,促进了H2A-H2B二聚体与(H3-H4)2四聚体的结合(图2C,2E)。综上,Spt16、Mcm2-HBD以及Tof1-HTH以分子伴侣的形式保护了组蛋白六聚体解离DNA后暴露出的结合界面,从而维持核小体解组装后的组蛋白亚复合物的稳定性。
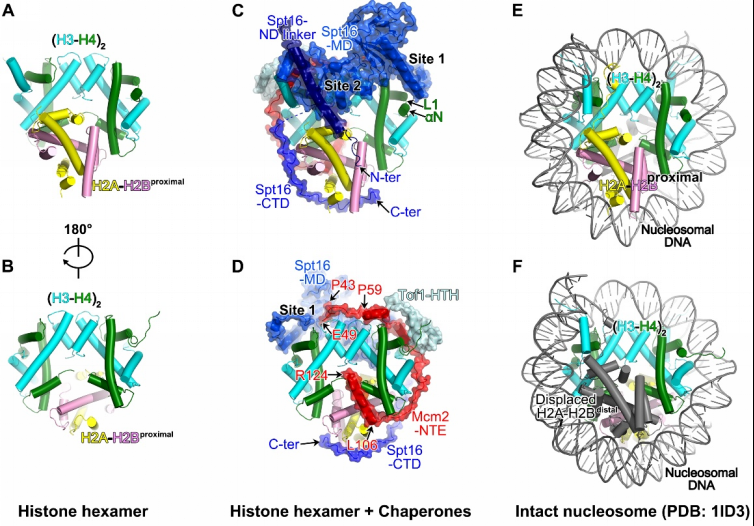
图2,复制体复制物中的组蛋白六聚体及其分子伴侣。(A-B)组蛋白六聚体;(C-D)结合在复制体中组蛋白-分子伴侣复合物;(E-F)核小体。
在复制叉的前端,Mcm2-NTE和Tof1紧密互作,组成了一个组蛋白六聚体的结合平台
(图1)
,使得六聚体靠近Ctf4区域,而Ctf4恰好是滞后链DNA聚合酶的结合位点。与这一结构观察一致的是,已有文章报道Mcm2-HBD促进亲代组蛋白分配至新生DNA的滞后链
【10,11】
。因此,Mcm2-NTE与Tof1的互作可能一定程度上影响亲代组蛋白在前导链和滞后链之间的分配。论文进一步设计了相应的突变株,以干扰Mcm2-NTE和Tof1的结合。基于新生DNA测序的eSPAN
(enrichment and sequencing of protein-associated nascent DNA)
实验分析表明,破坏Mcm2-NTE与Tof1的相互作用会严重影响亲代组蛋白回收和递送至新生成滞后链DNA的比例。
这项工作清晰的展示了DNA复制偶联的亲代组蛋白回收过程中一个关键中间步骤的分子细节,阐明了FACT、Tof1、Mcm2等在亲本组蛋白回收过程中的分子机制,表明组蛋白六聚体很可能是亲本组蛋白的一种回收单元,为全面揭示DNA复制偶联的表观遗传信息的继承机制奠定了重要的基础。
值得一提的是,Science China Life Science杂志Letter栏目发表中国科学院生物物理研究所许瑞明课题组题为“Structure of a histone hexamer bound by the chaperone domains of SPT16 and MCM2”的文章,发布了人源的FACT复合物亚基SPT16, MCM2和组蛋白的复合体晶体结构。该结构表明,老核小体重新利用的单元应该是由一个(H3-H4)2四聚体和一个H2A-H2B二聚体构成的组蛋白六聚体。
(关于上述两个工作的总结和比较,详见朱冰研究员的专文点评,BioArt今日单独推送)
翟元梁教授、高宁教授、李晴教授、戴碧瓘教授为本文的共同通讯作者,北京大学李宁宁研究员、香港大学博士生高源、北京大学博士生张煜婕、香港大学余大启博士
(之前在香港科技大学)
为本文的共同第一作者。香港大学李祥教授、刘扬教授、周钶达教授、林剑威博士、博士生李健、许志纯博士,香港科技大学党尚宇教授、张盈怡博士,北京大学冯建勋副研究员也参与了这项工作。
专家点评
真核生物基因组DNA的稳定性和功能深受染色质的结构与组织的影响。在细胞分裂过程中,不仅要确保整个基因组DNA的准确复制,还需在新生成DNA链上重现染色质的结构图谱。DNA 复制过程中,不同染色质状态如何有效传递和维持是表观遗传学的核心议题。
组蛋白是真核细胞染色质基本单元——核小体的骨架蛋白。携带特定修饰的亲本组蛋白是表观遗传信息最重要的载体。当DNA进行复制时,每个复制叉前面的亲代核小体会快速拆解,以促进有效的 DNA合成。复制完成后,组蛋白会通过两条途径在新生的DNA链上重建核小体:一是从头开始利用新合成的组蛋白组装,二是通过回收亲本组蛋白重塑核小体。核小体组装是一个渐进的过程,首先组装H3-H4 四聚体,然后快速招募H2A-H2B二聚体。在酵母细胞中,新生的H3-H4 二聚体在Asf1的引导下 ,H3的第56位赖氨酸被Rtt109乙酰化修饰(H3K56ac),之后Asf1将H3-H4 二聚体传递给下游分子伴侣,包括 CAF-1复合物等,以组装新生(H3-H4)2四聚体并形成核小体 。然而,我们目前对于亲代组蛋白如何被有效回收以重建相关表观遗传信息的了解仍然有限。
最近的研究发现,一些复制体的组分具有组蛋白伴侣活性,并能够促进亲代 H3-H4 转移到新合成的DNA链上。以芽殖酵母为例,通过eSPAN(蛋白质相关新生 DNA富集和测序)方法的分析发现,Pol ε 的两个亚基 Dpb3 和 Dpb4能够通过与H3-H4相互作用,促进亲代组蛋白转移到前导链DNA。此外,Mcm2作为MCM解旋酶的一个重要亚基,其N末端包含一段保守的组蛋白结合序列(HBM)。eSPAN分析还显示,组蛋白结合缺陷的 Mcm2-HBM突变体会严重影响酵母中亲代组蛋白向滞后链的转移。同样的结果在小鼠胚胎干细胞等哺乳动物细胞中也被报道。这些发现都证实了MCM2在亲代组蛋白转移中的保守作用。尽管这些突破性的发现为我们揭示了表观遗传信息在复制过程中传递机制的一些方面,但亲本组蛋白被复制体转移的具体分子机制仍然是一个待解之谜。
香港大学翟元梁教授,北京大学高宁教授、李晴教授和康奈尔大学戴碧瓘教授团队在Nature杂志的这一工作,首次揭示了亲本组蛋白在复制叉转移过程中的高分辨率冷冻结构,这对于深入理解组蛋白编码的表观遗传信息的遗传机制具有里程碑式的意义。在这项研究中,研究团队运用冷冻电镜技术成功解析了从酵母细胞中纯化的内源复制体结构。令人振奋的是,结构信息显示,FACT和Mcm2-HBD能够与由H3-H4四聚体和一个H2A-H2B二聚体组成的组蛋白六聚体相结合。这一组蛋白六聚体与亲本DNA分子完全分离,并暂时被转移到位于复制体前端的Tof1蛋白表面。更为重要的是,研究团队还发现了Mcm2-HBD和Tof1之间的相互作用,这种相互作用介导了亲代组蛋白向滞后链的转移。
这些发现为深入研究亲代组蛋白在复制过程中的传递和回收机制提供了宝贵的线索和方向。然而,目前仍有许多问题亟待解决。例如,在亲本核小体分解过程中,组蛋白八聚体如何分裂成(H3–H4)2-H2A-H2B六聚体和一个H2A–H2B二聚体,以及这个组蛋白六聚体单元是否作为一个整体被回收利用,仍需进一步的研究。此外,解离的亲本H2A-H2B的命运也是一个令人困惑的问题。同时,亲本组蛋白如何被有效转移到前导链DNA上,以及Pol ε在这一过程中扮演的角色,也亟待揭示。
这项工作所揭示的结构信息为体外重建复制偶联核小体的拆解和随后的重新组装以及相关功能分析奠定了坚实的基础。随着研究的深入,我们有理由相信,未来会有更多的亲本组蛋白在复制叉处转移的中间体被捕获,这将有助于我们更清晰地揭示组蛋白回收到新合成的前导链和滞后链中的确切作用。这一领域的研究将为我们提供全新的视角来审视和理解DNA复制过程中表观遗传信息的传递和维持机制。
3月6日,香港大学翟元梁教授、北京大学高宁教授和李晴教授及康奈尔大学戴碧瓘教授合作,在Nature杂志发表题为“Parental histone transfer caught at the replication fork”的研究论文。该研究利用酵母纯化的内源性复制体样品,成功捕捉到DNA复制过程中一个关键中间状态DNA-replisome-FACT-histone复合物的高分辨冷冻电镜结构,为理解染色质结构基础上的DNA复制过程开启新的视角。
真核生物的基因组DNA总是以染色质的形成存储在细胞核内。在细胞分裂过程中,染色质状态的复制遗传是维持细胞命运的关键核心问题。在DNA复制过程中,核小体作为染色质结构基本单元,伴随DNA复制叉进行动态的解组装和重组装。复制叉前的亲代核小体结构需要被解组装,暴露DNA方便复制叉打开DNA双链进行DNA复制;同时亲代核小体上的组蛋白被回收到复制叉后面新生成的子链DNA上重新组装形成核小体,实现表观遗传信息的传递和继承。组蛋白上的表观遗传信息继承和维持最核心的两个事件是:1)亲代组蛋白在DNA复制过程中如何被随机平均分配到新合成的子链—前导链和滞后链上形成核小体;2)新合成组蛋白如何组装形成核小体和表观遗传信息的重建, 以确保表观遗传信息在亲子代间的准确传递。我国朱冰团队发现,在DNA复制过程中,组蛋白H3-H4四聚体以全保留的方式分配到新合成子链DNA上,揭示组蛋白H3-H4上表观遗传修饰继承的分子机制。美国哥伦比亚大学张志国团队和丹麦哥本哈根大学的Anja Groth团队准确地测量组蛋白及其修饰在前导链和滞后链上的相对分布,研究发现绝大多数组蛋白修饰在两条新合成子链之间呈现出对称性分布。然而,令人惊讶的是,张志国团队最近发现H3K9me3显现出非常独特的分配模式,显著富集于前导链的LINE转座元件上。我们团队和合作者利用单分子技术,研究发现组蛋白分子伴侣FACT具有核小体解组装和重组装双重功能,在DNA复制和基因转录过程中核小体解组装和亲本组蛋白回收中具有重要调控功能。综上所述,已有研究发现多种蛋白质因子参与这一过程,但是对于这些因子如何促进DNA复制偶联的亲代核小体解组装和亲代组蛋白的回收及其在新生核小体上的重组装过程仍然并不清楚。
在该研究工作中,合作团队首次从大规模培养的细胞周期同步的酿酒酵母细胞中,利用亲和纯化标签、染色质富集、梯度交联等大分子复合物纯化技术成功纯化出内源的复制体复合物,成功获得有FACT和亲代组蛋白的复制体复合物的3.5埃高分辨冷冻电镜结构。该结构清晰的展示了DNA复制偶联的亲代组蛋白回收过程中一个关键节点的分子细节,揭示在复制叉前组蛋白以六聚体形式在Spt16、Mcm2-HBD以及Tof1-HTH的保护下脱离亲本DNA的过程,并结合新生DNA测序eSPAN实验,阐明了FACT与Tof1、Mcm2等染色质复制因子在组蛋白回收并递送至新生滞后链过程中的分子角色,为全面阐释DNA复制偶联的表观遗传信息的传递和继承机制奠定了重要的基础。
有趣的是,该研究结果首次发现在DNA复制过程中,亲代组蛋白可能以六聚体形式,包含1个(H3-H4)2四聚体和1个H2A-H2B二聚体进行递送,既支持了前期发现H3-H4四聚体全保留的分配模式,同时也为探讨H2A-H2B上的表观修饰信息在染色质复制过程的遗传机制提供支撑。早期研究基于H2A-H2B二聚体在染色质上的高度动态性,在染色质复制研究中多以H3-H4四聚体为基准研究组蛋白表观特征的遗传,而忽视H2A-H2B上的表观信息的继承。我们团队前期发现,30纳米染色质纤维可以通过核小体-核小体配对原理促进DNA复制过程中H3K27me3和H2AK119ub1的快速蔓延和重建。最近,哥本哈根大学Anja Groth团队发现DNA复制过程中亲本组蛋白H2A-H2B上的表观遗传信息也可以快速回收,并在H3-H4之前完成重建,从而实现表观遗传的快速记忆,支持了我们H2AK119ub1作为表观遗传记忆的观点。
同时,该研究工作也为FACT复合物在染色质复制过程中作用提供了新的视角。FACT复合物作为组蛋白分子伴侣参与维持核小体完整性,并调控核小体结构的组装和去组装,在所有染色质相关的生物学过程包括转录、DNA复制和损伤修复等都具有非常重要的功能。早期研究发现FACT参与复制叉前核小体的解组装,在亲本组蛋白的回收和新合成组蛋白的呈递中发挥作用,但具体机制一直并不清楚。该研究首次揭示FACT复合物与复制体偶联,协同促进亲代组蛋白六聚体在复制叉回收的分子基础,并系统比较FACT复合物从结合核小体到亚核小体到组蛋白六聚体、组蛋白H3-H4四聚体等不同结构状态的变化过程,为理解FACT复合物动态调控核小体的分子机制奠定基础。但是,我们最近研究发现FACT复合物的核小体解组装和重组装功能受到多种表观因子的调控,比如组蛋白H2AK119和H2BK120泛素修饰、组蛋白变体H2A.Z、H2AX、macroH2A等。这些不同的表观调控信息是否在染色质复制过程中与FACT复合物互作,调控相应的亲代组蛋白回收或递送至新生后滞链或前导链也有待于深入探讨。另外,作为亲代核小体上的组蛋白八聚体,另外一个亲代H2A-H2B二聚体的去向也值得后续深入研究。它被Mcm2-HBD的一段长Helix从组蛋白八聚体上解离后,是被该复合物中的其它组分结合维持在这个结构中,但是高度动态不能被解析,还是被完全分离出去仍然有待于探讨。
综述所述,该合作团队的这项工作实验设计巧妙,实验体系复杂,难度大,内容丰富,研究思路新颖,结构非常漂亮。该项研究不仅为理解染色质结构基础上的DNA复制过程开启新的视角,同时阐明了FACT与Tof1、Mcm2等染色质复制因子在亲本组蛋白回收和递送中的重要功能,为全面阐释DNA复制过程中表观遗传信息的传递和继承机制奠定了重要的基础。在此,再次祝贺合作团队在DNA复制调控机制研究方向上取得又一重要进展,期待他们团队在后续研究中取得更多的突破。
https://doi.org/10.1038/s41586-024-07152-2