Nature | 生命科学学院高宁研究组与合作者解析人源T细胞受体-共受体复合物结构
8月28日,北京大学生命科学学院高宁课题组与哈尔滨工业大学黄志伟课题组合作在Nature上发表了题为“Structural basis of assembly of the human TCR-CD3 complex”的研究论文,报道了利用冷冻电镜技术解析的人源T细胞受体-共受体的高分辨结构。
T细胞是脊椎动物适应性免疫系统的关键细胞,在病毒感染、癌症以及自体免疫疾病中起着关键作用。T细胞免疫反应包括由TCR首先识别抗原呈递细胞(APC)上结合了抗原肽的MHC复合物(pMHC),然后TCR通过其结合的共受体(CD3)将抗原信号传递到CD3的ζ亚基的胞内ITAM区域,进而启动T细胞内级联免疫信号通路杀死病原感染细胞或肿瘤细胞。
大多数成熟T细胞(约95%)的TCR由通过二硫键相连的α和β两条异二聚体肽链组成,TCRα/β的可变区(Vα和Vβ)负责识别抗原信号,TCRα/β与含有γ/ε、δ/ε’和ζ/ζ’六个亚基进行信号传递的共受体CD3组成TCR-CD3受体复合物,该复合物决定着T细胞的发育、激活以及对病原的免疫反应。在过去的二十年中,人们对TCR胞外可变区如何识别各种抗原进行了很深入的研究,但作为细胞免疫基础科学问题之一的TCR-CD3复合物组装以及信号转导的结构基础仍然未知。
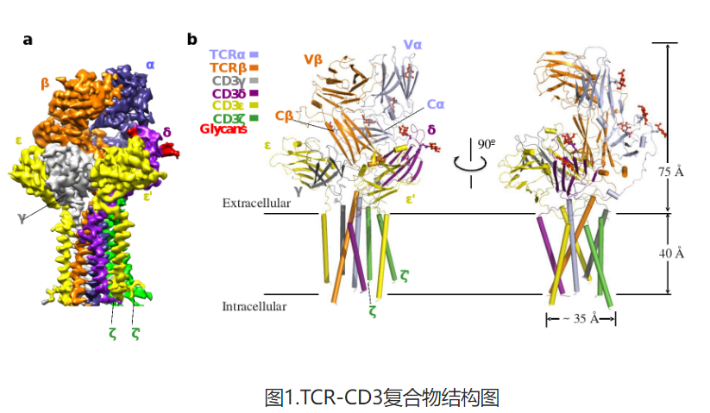
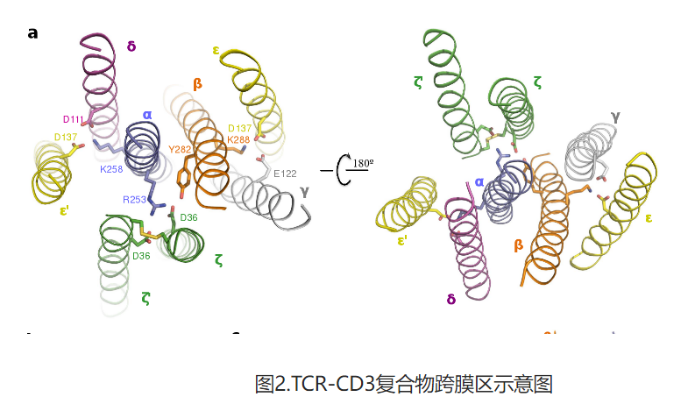
TCR-CD3复合物结构包含完整的胞外结构域(ECD)以及所有跨膜区域(图1)。TCR-CD3复合物的胞外区域由TCRα/β的恒定区以及连接胞外和膜内的连接肽结合CD3的γ/ε和δ/ε’两个二聚体模块组装而成,TCR-CD3复合物胞外区域的组装在接近细胞膜的外侧形成类三次对称的结构,TCRβ亚基的恒定区位于该三次对称结构的中心位置。CD3膜内部分由ζ/ζ’亚基的两个跨膜螺旋和γ/ε以及δ/ε’亚基的跨膜螺旋结合形成桶状构象。TCR-CD3复合物膜内组装由TCRα/β的两个跨膜螺旋通过疏水和电荷作用插入CD3筒状跨膜结构中形成(图2)。所以,TCR-CD3各亚基近膜侧的连接肽以及膜内区域的强相互作用对整个复合物的组装起着关键作用。
这一工作揭示了TCR和CD3亚基在膜外侧以及膜内识别、组装成功能复合物的分子机制,从而回答了免疫领域关于T细胞受体结构的基础科学问题,而且对解析T细胞活化的分子机制具有重要的科学意义,同时也为开发基于T细胞受体的免疫疗法提供关键结构基础。
董德(黄志伟组)、郑吕钦(高宁组)、林建铨(黄志伟组)为该研究论文的共同第一作者,黄志伟和高宁为本研究论文的通讯作者。高宁组李宁宁副研究员也参与该研究的部分工作。该研究得到了国家重点研发计划、国家自然科学基金委、生命联合中心、膜生物学国家重点实验室的经费支持,以及北京大学冷冻电镜平台、北京大学高性能计算中心、北京大学生命科学学院仪器中心的支持。
文章来自:北京大学新闻网


