Nat Commun | 尹玉新课题组揭示磷脂酰肌醇二磷酸PIP2调控转运蛋白BTR1结构与功能的分子机制
细胞内pH稳态的维持是细胞正常生长发育的必要条件,多个溶质转运蛋白家族成员参与该过程的调控,其中SLC4家族转运蛋白主要通过钠离子、氯离子和碳酸氢根离子等离子的跨膜转运参与细胞生理活动【1】。SLC4家族目前已被鉴定出10种成员,包括AE1-AE4、NBCe1-2、NBCn1-2、NDCBE和BTR1【2】。BTR1是SLC4家族中不转运碳酸氢根的“特殊”成员,在发现之初被认为可能参与哺乳动物的硼酸根离子转运过程【3】,但后续的功能研究揭示其主要作为 H+(OH-)转运体发挥pH调节的功能【4, 5】。BTR1广泛表达于角膜内皮细胞、肾脏、唾液腺、睾丸、甲状腺和气管【6】,SLC4A11基因突变导致的功能异常与先天性遗传性内皮营养不良 (CHED)【7】和Fuchs内皮性角膜营养不良 (FECD)【8】等疾病相关。然而,BTR1在体内的调控方式以及胞内结构域在底物转运过程中的作用仍不清楚。
2023年10月3日,北大-清华生命科学联合中心、北京大学基础医学院尹玉新课题组在Nature Communications杂志上发表题为Structural insights into the conformational changes of BTR1/SLC4A11 in complex with PIP2的文章,首次报导了转运蛋白BTR1在静息状态、低pH状态和携带致病突变R125H等条件下的高分辨冷冻电镜结构,揭示了磷脂酰肌醇二磷酸PIP2与BTR1的相互作用模式。

此研究首先解析了静息状态下(BTR1OF/APO)和NH4Cl存在状态下(BTR1OF/NH3)的BTR1结构,两种状态结构相似,均处于细胞外侧开放构象。BTR1OF/APO具有清晰的跨膜区(TMD)密度和相对完整的N端胞内区(NTD)密度,单体内TMD和NTD之间观察到清晰的特征符合磷脂酰肌醇二磷酸PIP2的分子密度。PIP2通过疏水尾部与TMD的V850、L808、L809和V837互作,肌醇头部与NTD的R125, R128, R227, K260和K263互作,稳定TMD和NTD相互作用界面。NTD的R125、K260和K263突变显著降低BTR1的NH3激活电流,表明PIP2对BTR1具有激活作用(图1)。
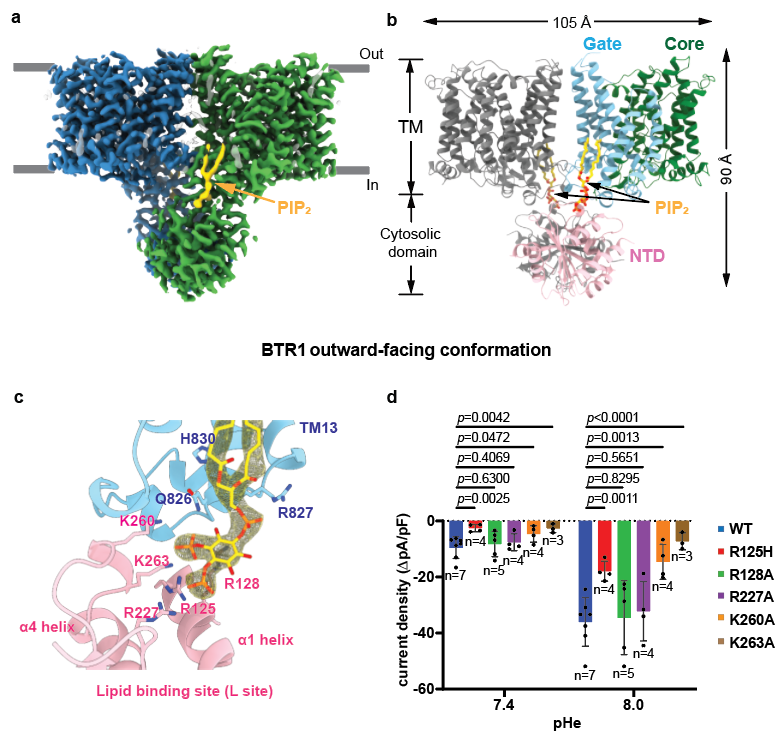
图1 BTR1OF/APO结构及PIP2结合位点。
将NTD上与PIP2相互作用的氨基酸突变(BTR1IF/R125H)或降低BTR1所在环境pH(BTR1IF/5.5),BTR1的TMD和NTD构象发生明显变化。BTR1IF/R125H和BTR1IF/5.5构象相似且均无明显的PIP2电子密度,跨膜区由细胞外侧开放构象变为细胞内侧开放构象,gate结构域无明显变化,而core结构域向细胞内侧旋转。失去PIP2相互作用的NTD二聚体上下翻转并与TMD形成新的相互作用界面,将TMD稳定在胞内侧开放构象(图2)。
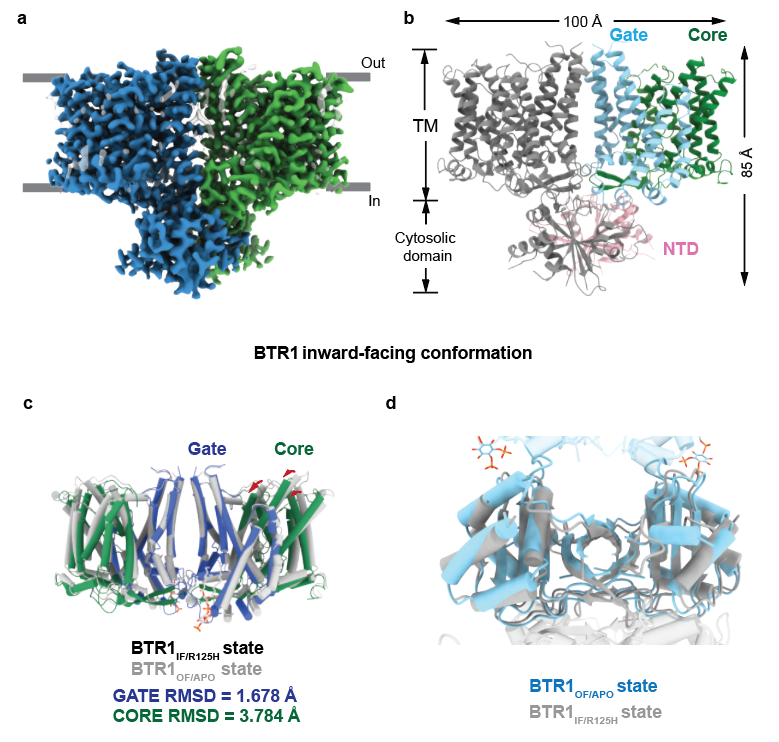
图2 BTR1IF/R125H结构以及和BTR1OF/APO结构比较。
综上所述,该研究通过解析不同状态BTR1结构,揭示了PIP2对BTR1的激活作用以及PIP2结合对BTR1构象的影响,为进一步研究BTR1突变致病机制以及BTR1和其他SLC4转运体的调控机制提供了结构基础。
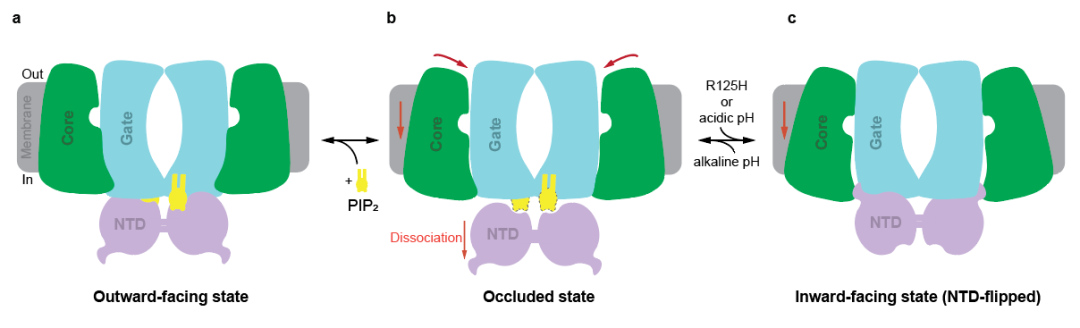
图3 PIP2调节BTR1构象变化模式图
北京大学系统生物医学研究所尹玉新教授为本文的通讯作者。北大-清华生命科学联合中心博士研究生吕祎硕和北京大学基础医学院博士研究生佐鹏为本研究论文的共同第一作者。北京大学基础医学院博士后丁典和北大-清华生命科学联合中心博士研究生陈竑屹为本研究做出了重大贡献。
原文链接:
https://www.nature.com/articles/s41467-023-41924-0


