Nature | 毛有东课题组与合作者在《自然》发表NLRP3炎症小体激活新机制
2019年6月12日,北京大学物理学院、人工微结构介观物理重点实验室、定量生物学中心毛有东课题组与哈佛医学院吴皓课题组合作在《自然》杂志发表题为“Structural mechanism for NEK7-licensed activation of NLRP3 inflammasome”的研究长文,通过冷冻电子显微镜方法解析了人源NLRP3-NEK7的复合物3.8埃分辨率的结构,并通过NLRP3或NEK7突变体的体外和细胞功能研究,系统揭示了NEK7与NLRP3亚基的多界面相互作用,以及其介导NLRP3炎症小体激活的分子机制。《自然》在News and Views栏目同期发表了题为“A licence to kill during inflammation”的特约评论文章,对这一成果作了专题亮点介绍。
炎症小体是一种多蛋白复合物,负责激活炎症反应,在先天免疫和炎症相关的疾病发生过程中具有重要作用。炎症小体激发caspase-1的活化,进而在天然免疫防御的过程中,促进细胞因子白细胞介素1β(IL-1β)和白细胞介素18(IL-18)的成熟和分泌。这些细胞因子的分泌可导致细胞焦亡(pyroptosis)。目前已发现多种炎症小体,如NLRP1、NLRP3、NLRC4和AIM2。NLRP3炎性体可以被尼日利亚毒素、尿酸结晶、淀粉样蛋白-β原纤维和外源ATP等来激活。NLRP3炎症小体在多种心血管疾病、神经退行性疾病和肿瘤发生的过程中扮演着重要角色,包括家族周期性自身炎症反应、II型糖尿病、阿尔兹海默症、关节炎症和动脉粥样硬化症等。
丝氨酸/苏氨酸激酶NEK7在有丝分裂过程中起着关键作用。最近的研究揭示,NEK7在有丝分裂间期中参与组装和激活NLRP3炎症小体。然而,NLRP3-NEK7相互作用的分子机制和NLRP3的分子结构仍然未知。尽管NLRP3是最早被鉴定的炎症小体感应器之一,但由于其结构的内在动态性,无法形成高质量的蛋白晶体,长期以来X射线晶体学方法未能在其结构解析中发挥作用。在该《自然》报道的研究中,作者们通过重组表达,在昆虫细胞中表达量人源N端PYD截短、融合MBP标签的NLRP3,通过大肠杆菌表达了全长的人源NEK7。但是天然复合物的冷冻电镜图片对比度很差(分子量185KD)。于是作者通过人工干预,基于二聚体蛋白激酶R,设计了人工的NEK7使其二聚化,改善了复合物的电镜数据质量。最终,课题组获取了高分辨的复合物冷冻电镜图片,通过整合倾斜样品和非倾斜样品的数据,以及基于机器学习的数据聚类,对结构精化做了一系列优化,解析了其三维结构,分辨率达到3.8 Å(如图)。对NLRP3的结构和功能的研究证明NLRP3-NEK7相互作用决定了NEK7许可对NLRP3炎症小体激活的必要性,为进一步
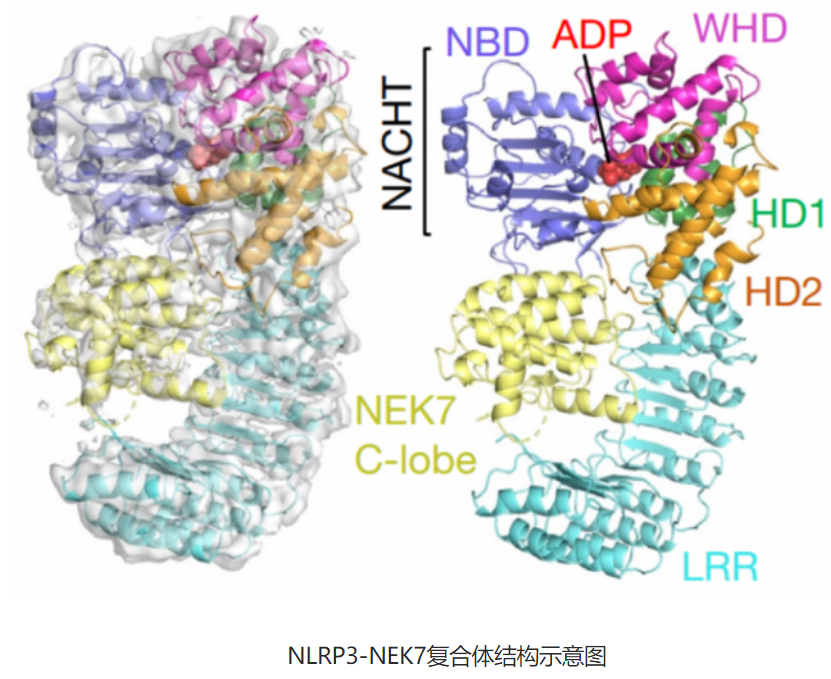
研究NLRP3炎症小体激活的分子机制提供了重要基础,为相关疾病的分子医学研究提供了必备的分子依据和药物治疗靶点。
北京大学物理学院毛有东与哈佛医学院吴皓为论文共同通讯作者。这项研究得到了国家自然科学基金委(项目编号:11774012)、北京市自然科学基金委(项目编号:Z180016)和美国国家健康研究院的资助。该研究中用于3.8埃结构重建的全部300kV冷冻电镜数据采集在北京大学电镜实验室和冷冻电镜平台上完成。部分数据处理在北京大学未名一号和生科一号高性能计算平台上完成。
文章来自:北京大学新闻网


