Nature | 生科高宁研究组与合作者发表DNA复制起点识别复合物3-Å分辨率的冷冻电镜结构
2018年7月4日,北京大学生命科学学院、北京大学-清华大学生命科学联合中心高宁教授课题组与香港科技大学戴碧瓘教授课题组合作,在《自然》(Nature)杂志以长文形式发表题为“Structure of the origin recognition complex bound to DNA replication origin”的研究论文,报道了结合有复制起点DNA(ARS305)的酿酒酵母起点识别复合物(ORC)3-Å分辨率的冷冻电镜结构。此高分辨率结构不仅为理解酵母ORC如何识别和结合序列特异性的DNA复制起点提供了分子基础,同时也阐明了ORC如何通过弯曲DNA来进一步加载DNA复制解旋酶MCM2-7的分子过程。
DNA复制起始在真核生物细胞体中受到严格精密调控。DNA复制启动因子首先结合到DNA复制起点,以加载DNA复制解旋酶MCM2-7复合物到DNA上,随后MCM2-7被激活,DNA双链被解螺旋,从而启动DNA复制。真核生物的复制启动因子ORC由六个亚基组成。所有真核生物都是利用ORC来标记DNA复制起始的位点。除了在基因组稳定性以及肿瘤的发生发展中显而易见的重要作用,人源 ORC复合物的多个亚基(包括ORC1,ORC4,ORC6,Cdc6)的功能缺失突变都和一类罕见遗传发育疾病直接相关(Meier-Gorlin syndrome,MGS)。MGS患者在胚胎期生长迟缓并伴随多种发育畸形,出生后发育也严重受阻并导致身材矮小、小耳症、膝盖骨缺失等。

虽然在不同的真核生物中,ORC的蛋白质序列高度保守,但是ORC对DNA复制起点序列的选择性在不同物种间差别很大。酿酒酵母的ORC可以识别特异的DNA复制起点,而人源细胞的ORC结合的DNA序列却没有序列特异性,主要依赖染色体结构识别复制起点。ORC序列识别差异背后的分子机制,也一直是个未解之谜。造成这种局面的一个很大的原因,就是多年来一直缺少ORC结合DNA的高分辨结构。已经发表的关于ORC结构中,要么复合物中没有DNA,要么分辨率较低,不足以提供足够的细节信息,我们仍然无法推测ORC与DNA是如何相互作用从而实现其功能的。为了解开这个谜团,高宁课题组和戴碧瓘课题组克服一些技术难题,合作解析了酿酒酵母ORC结合DNA复制起始位点3-Å分辨率的冷冻电镜结构。
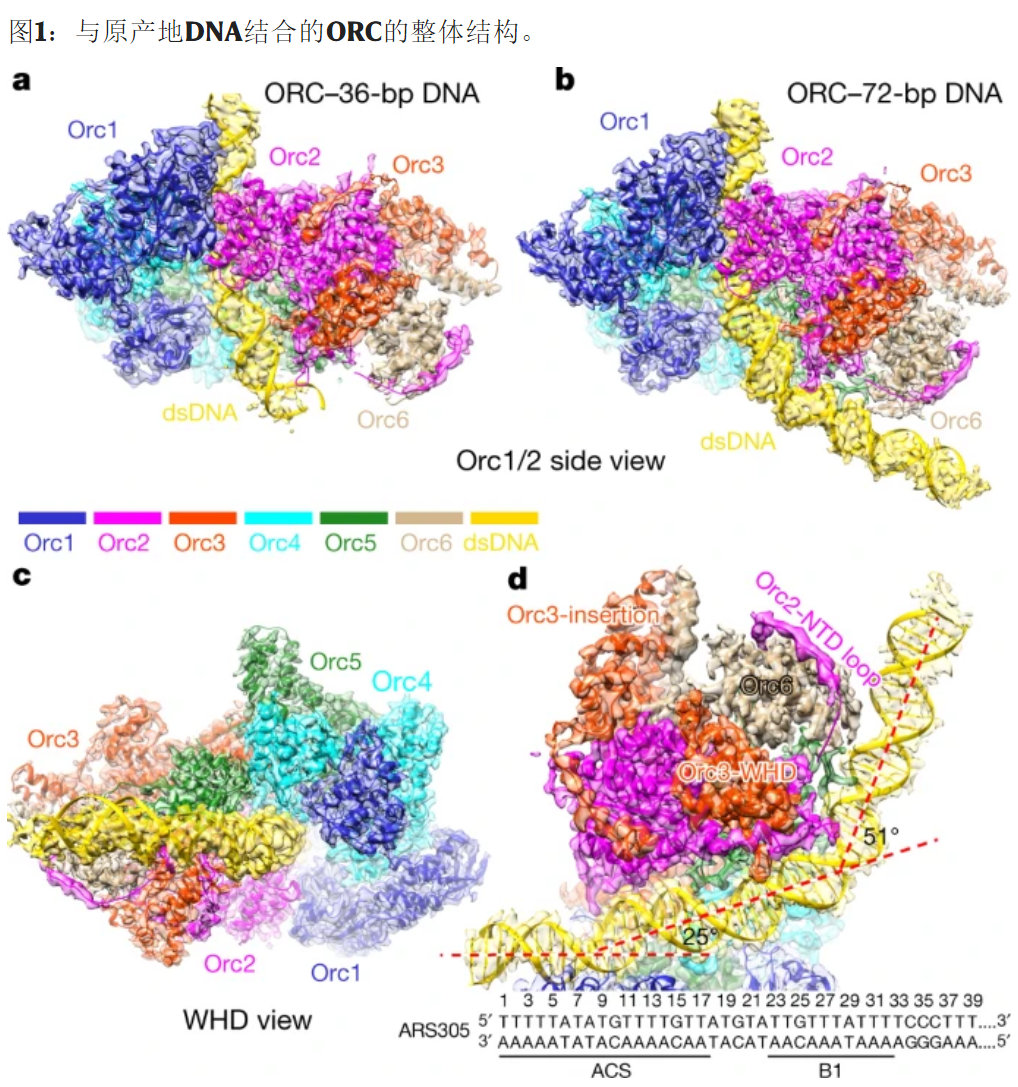
a,ORC-DNA复合物(36 bp)的冷冻电镜密度图的侧视图,叠加了原子模型。dsDNA,双链DNA。b,c,Side(Orc1 / Orc2)(b)和底部(WHD)(c)ORC-DNA复合物(72 bp)的观点。d,ORC-72-bp DNA复合物的剖视图,突出了Orc6与Orc2和Orc3的相互作用。图中显示了ARS305序列,DNA的连续弯曲由红色虚线表示。为清楚起见,省略了其他兽人亚基。NTD,N端域。
本文解析的ORC-ARS305 DNA复合物结构中,ARS305包含一段ARS高度保守序列(ARS consensus sequence, ACS)和一段B1元件序列,长度为72 bp。在这个结构中,ORC的六个亚基通过与磷酸骨架的非特异性以及与碱基的特异性相互作用环绕DNA,并在ACS和B1位点使DNA发生弯曲。该结构的一个关键特征是Orc1的保守碱性氨基酸区域(Orc1-BP,basic patch)深深地插入ACS的小沟中进行序列特异的碱基识别。另外,酵母特有的具有物种特异性的位于Orc4 Wing Helix结构域(WHD)中的Helix Insertion(Orc4-IH)嵌入ACS的大沟中,与相应的碱基形成疏水相互作用。重要的是,在ACS区域形成的这些碱基特异的相互作用的碱基都非常保守。此外,在B1区域中,也有类似的来自Orc2和Orc5的碱性氨基酸区域插入到大沟和小沟中,与碱基相互作用,并使DNA弯曲。因此,酿酒酵母ORC高度序列特异性主要是通过ORC亚基的大沟、小沟插入基序与ACS保守碱基之间的特异性相互作用实现的。序列比对分析显示,所有真核生物Orc1的N端都具有类似酿酒酵母的Orc1-BP;然而Orc4-IH却只在酿酒酵母中存在。这些发现,很大程度上解释了不同物种ORC识别起始DNA特异性差异背后的原因。
高宁以及戴碧瓘、香港科技大学翟元樑博士(现为香港大学助理教授)为本文的共同通讯作者。高宁组的博士后李宁宁、博士生程稼萱以及戴碧瓘组的博士后林伟熙、翟元樑为本文的共同第一作者。高宁组的成二超(2017年已博士毕业)和戴碧瓘组的博士赵永倩参与了研究工作。冷冻电镜数据收集工作主要在北京大学电子显微镜实验室(冷冻电镜平台)完成,平台的李雪梅老师和物理学院的余大启博士在数据收集过程中提供帮助;国家蛋白质科学(北京)设施清华大学冷冻电镜平台为本课题的早期研究提供支持。冷冻电镜数据处理主要在北京大学高性能计算中心完成,平台主管樊春老师亦提供帮助。本论文得到科技部、国家自然科学基金委、香港研究资助局、中国博士后基金的经费支持。李宁宁获得北京大学-清华大学生命科学联合中心优秀博士后基金的资助。
高宁课题组和戴碧瓘课题组从2013年开始合作,在真核生物DNA复制起始调控机制的研究方面取得了很好的成果。他们先后解析了酵母DNA复制解旋酶双六聚体复合物Mcm2-7的3.8-Å的冷冻电镜结构(Nature, 2015)以及解旋酶加载到DNA前游离的Mcm2-7六聚体和Cdt1-Mcm2-7七聚体复合物的结构(Nat Struct&Mol Biol, 2017)。
值得一提的是,这是北京大学冷冻电镜平台自2017年秋季正式运行以来,其产出的研究成果首次在国际顶级期刊上发表。ORC-DNA复合物的分子量为400kD左右,颗粒较小,分辨率可以达到3Å,这表明北京大学冷冻电镜平台的硬件建设的初步目标已经圆满达成。
文章来自:北京大学新闻网