NSMB |高宁研究组合作解析细胞内维持GDP-甘露糖稳态的分子机制
2021年5月13日,北京大学高宁课题组与四川大学贾大课题组合作,在NSMB上发表了题为Cryo-EM structures of human GMPPA–GMPPB complex reveal how cells maintain GDP-mannose homeostasis的文章。该研究首次报道了人类甘露糖焦磷酸化酶B (GMPPB)和甘露糖焦磷酸化酶A (GMPPA)复合物的冷冻电镜结构,并综合利用生化、细胞及斑马鱼模型揭示了GMPPA通过变构调节GMPPB活性来维持GDP-甘露糖稳态的机制,阐明了GMPPB和GMPPA复合物之间的互作以及GDP-甘露糖在神经发育等方面所发挥的重要作用。该研究在探索GMPPA/B基因突变导致先天性糖基化紊乱的分子机制的道路上迈出了重要的一步。
首先,研究者采用冷冻电镜单颗粒技术解析了在GDP-甘露糖或GTP结合的情况下GMPPA/GMPPB复合物3种结构。GMPPA/GMPPB复合物包含四个GMPPA亚基和八个GMPPB亚基,形成了一个四层的结构 (B4-A2-A2-B4)(图1)。结构分析表明该复合物存在三种类型的相互作用界面,GMPPB和GMPPA/B之间的II型相互作用界面对于复合体的组装最为关键。紧接着研究者对GMPPA/GMPPB亚基的完整序列进行了精确建模,分析了GMPPA和GMPPB的结构域和催化中心。体外酶活及细胞实验表明单独的GMPPB亚基具有催化GDP-甘露糖生成的活性,GMPPA亚基本身不具有催化活性,反而作为抑制亚基在GMPPA/B复合物中发挥调节作用。
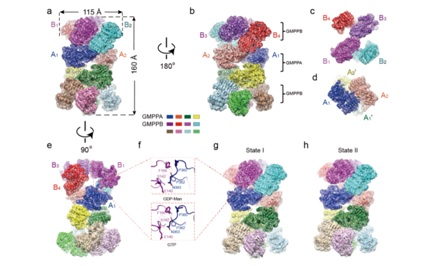
图1 GMPPA/GMPPB-GDP-甘露糖复合物和GMPPA/GMPPB-GTP复合物的结构
通过进一步的结构分析,研究者发现GMPPA存在两种主要构象:(1)在GDP-甘露糖结合的情况下,GMPPA通过其C端的一段loop(C-loop)和GMPPB的催化亚基相互(2)在GTP结合的情况下, C-loop处于完全不同的构象,不与GMPPB发生物理接触。这一发现暗示着GMPPA很有可能通过结合酶反应的产物来抑制GMPPB的催化活性。
基于这一线索,研究者展开了大量的体外生化实验,验证了GMPPA对于GMPPB的异构调控机制:(1)尽管GMPPA亚基不具备催化活性,但是相比于GMPPB,对于GDP-甘露糖有更高的亲和性(近一个数量级的差异);(2)GMPPA与GDP-甘露糖的亲和力,与细胞内GDP-甘露糖的浓度接近 (10-20 M);(3)GMPPA的E85K/Q247A双突变可以显著降低其结合GDP-甘露糖的能力,同时也极大程度上丧失了对GMPPB的抑制作用;(4)能够破坏GMPPA的C-loop 与 GMPPB催化亚基的突变同时也能够减轻GMPPA对于GMPPB的酶活抑制。
基于上述数据,研究者提出了GMPPA通过产物感知来异构调控GMPPB催化活性的模型,并进一步在细胞上验证了这一模型:GMPPA的表达下调可以导致细胞中GDP-甘露糖水平的升高。研究者选择GMPPA和GMPPB的错义突变或致病突变进行验证,发现这些突变通过影响底物结合、酶的催化作用或蛋白质的稳定性来损害复合物的装配和酶催化活性,从而影响GDP-甘露糖的产生。
最后,研究者通过利用模式动物斑马鱼分别建立GMPPA或GMPPB的敲降模型,发现GMPPB和GMPPA的敲降会使得斑马鱼轴突变短,肌纤维紊乱。这些表型缺陷可以被野生型的GMPPA或GMPPB回补,但是无法被来自于病人的致病突变体回补。此外,研究者通过注射不同浓度的GDP-甘露糖,证明适当浓度的GDP-甘露糖可以挽救GMPPB缺失导致的表型缺陷;与GMPPB不同,不同浓度GDP-甘露糖的注射无法挽救GMPPA失导致的表型缺陷。
总而言之,该项研究综合利用结构、生化、细胞和斑马鱼模型,阐明了GDP-甘露糖稳态调控对于机体正常发育的重要性,揭示了GMPPA作为胞内GDP-甘露糖的感受器(sensor)去感受胞内甘露糖浓度变化从而去变构调节GMPPB催化活性的机制。这一机制的阐明为先天性糖基化相关疾病的治疗提供了重要参考信息。
据悉,四川大学的贾大、北京大学的高宁教授为该论文的共同通讯作者。北京大学的博士生郑吕钦、四川大学的博士生刘哲、王焱为该论文的共同第一作者,四川大学的莫显明、蔡晓唐、阳繁、王瑾瑞、黄文杰及清华大学的刘晓慧等为课题提供了大力支持。
原文链接:https://www.nature.com/articles/s41594-021-00591-9


