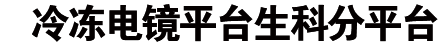Nature Communications | 陈雷组报道人源SGLT1抑制剂的结合模式
钠-葡萄糖共转运蛋白(SGLT)是人体中负责葡萄糖重吸收的重要转运蛋白,能够利用钠离子的电化学势进行葡萄糖的逆浓度梯度转运1。在人体中的SGLT蛋白家族中,SGLT1和SGLT2两个蛋白对葡萄糖的吸收和稳态最为关键。其中,SGLT1由SLC5A1基因编码,主要在小肠和肾脏近曲小管S3节段表达4,负责肠道中食物来源的葡萄糖及原尿中残余葡萄糖的重吸收,并且还有水通道的功能5。SGLT1的失活突变会导致肠道葡萄糖-半乳糖吸收不良症1;SGLT2由SLC5A2基因编码,主要在肾脏近曲小管S1和S2节段表达,负责原尿中90%的葡萄糖重吸收2,SGLT2的失活突变会导致家族性肾尿糖2,3。
作为II型糖尿病治疗的重要靶点,利用SGLT2抑制剂来治疗糖尿病的思路就是通过抑制SGLT2的糖转运功能,使得SGLT2无法从原尿中重吸收葡萄糖,导致多余的葡萄糖从尿液中排出以达到间接降低血糖的目的。已经有很多SGLT2抑制剂如恩格列净(Empagliflozin)、卡格列净(Canagliflozin)、达格列净(Dapagliflozin)6等小分子药物被研发出来用于临床治疗II型糖尿病。此外,最近的临床试验表明,与单独使用SGLT2抑制剂相比,同时抑制SGLT1和SGLT2在治疗II型糖尿病中可能会更有优势7,并且靶向SGLT1的抑制剂还有治疗便秘的效果8。
SGLT的抑制剂均是以天然产物根皮苷的结构为基础优化产生,根据它们的选择性可以将这些抑制剂分为三类:SGLT2特异性抑制剂,如恩格列净(Empagliflozin),卡格列净(Canagliflozin),达格列净(Dapagliflozin)等;SGLT1特异性抑制剂,如KGA-2727,mizagliflozin以及SGLT1-SGLT2非选择性抑制剂,如LX2761, 索格列净(sotagliflozin)等。因此,了解这些药物是如何抑制SGLT的功能对于药物开发和优化具有重要意义。
2021年12月,北京大学未来技术学院分子医学研究所陈雷课题组在Nature杂志首次报导了人源SGLT2-MAP17复合物与抑制剂恩格列净结合的结构9,同时,美国斯坦福大学冯亮课题组也在同期杂志上发表了人源SGLT1无配体结合状态的向内开口的结构10。但是SGLT1与抑制剂结合的模式,以及某些SGLT1特异性抑制剂的选择性机制仍然是未知的。
2022年10月28日,北京大学未来技术学院分子医学研究所、北大-清华生命科学联合中心陈雷研究组在Nature Communications杂志发表了题为 “Structural mechanism of SGLT1 inhibitors” 的研究论文,该研究通过单颗粒冷冻电镜解析了人源SGLT1-MAP17复合物与抑制剂LX2761结合的高分辨结构。
SGLT1与SGLT2的分子量接近,序列相似性较高,单独解析SGLT1蛋白的结构具有一定的挑战性。作者们发现SGLT1与SGLT2的TM13上与MAP17相互作用的氨基酸高度一致,推测SGLT1可能也可以与MAP17形成复合体。随后,这个猜想得到了实验的证实。在此基础上,作者们利用了在解析SGLT2结构中发明的“三接头策略”来进行SGLT1结构的解析:作者们将GFP融合在SGLT1的胞内区,将GFP纳米抗体融合在MAP17胞内端11,获得了具有功能同时又适合冷冻电镜研究的蛋白。作者们通过冷冻电镜单颗粒分析方法解析了人源SGLT1-MAP17复合体与抑制剂LX2761结合状态的高分辨率结构(图1)。
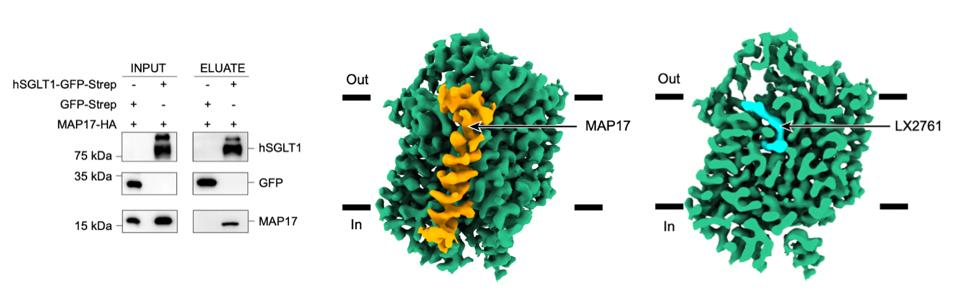
图1 SGLT1与MAP17相互作用及hSGLT1-MAP17复合体的电子密度图
通过结构比较发现,SGLT1与SGLT2的结构十分相似,具有相似的结构特征和拓扑特征。与无配体结合状态的SGLT1不同,抑制剂LX2761将SGLT1锁定在向外开放的构象(图2)。LX2761的糖基头部结合在SGLT1的底物结合位点,通过疏水相互作用与底物结合位点的氨基酸相互作用,长链尾巴向外延伸,阻塞胞外区的通道入口。作者将SGLT1的L274和 D454分别突变为丙氨酸发现,突变的SGLT2降低了和抑制剂的结合,减弱了抑制剂的抑制作用。
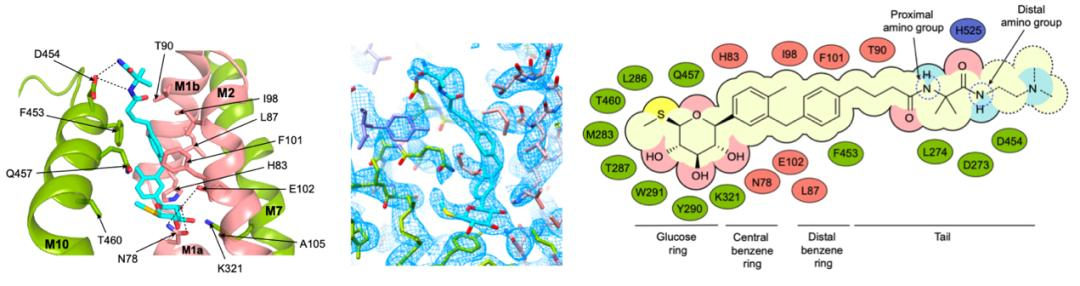
图2 抑制剂LX2761的结合位点
为了解释SGLT1特异性抑制剂mizagliflozin的选择性机制,作者们将SGLT1和SGLT2的抑制剂结合口袋进行了比较,发现在SGLT1中的结合口袋要略大于SGLT2,而这一差异来源于SGLT1第160位氨基酸的差异:SGLT1第160位丙氨酸对应于SGLT2的第157位缬氨酸。作者们通过分子动力学模拟对mizagliflozin与SGLT1的结合模式进行了模拟,并将模拟结果与SGLT2的结构进行了比对。结果发现由于LX2761的中央苯环基团被mizagliflozin的异丙基吡唑基取代,在SGLT2的V157位氨基酸处形成了空间冲突,这可能导致了mizagliflozin对SGLT2的效力降低。因此作者分别构建了SGLT1的A160V和SGLT2的V157A突变体,发现在SGLT1中将A突变为V会降低mizagliflozin的效力,而在SGLT2中将V突变为A则会提高mizagliflozin的效力(图3)。因此,作者们鉴定了SGLT1的A160为影响Mizagliflozin选择性的主要位点之一。
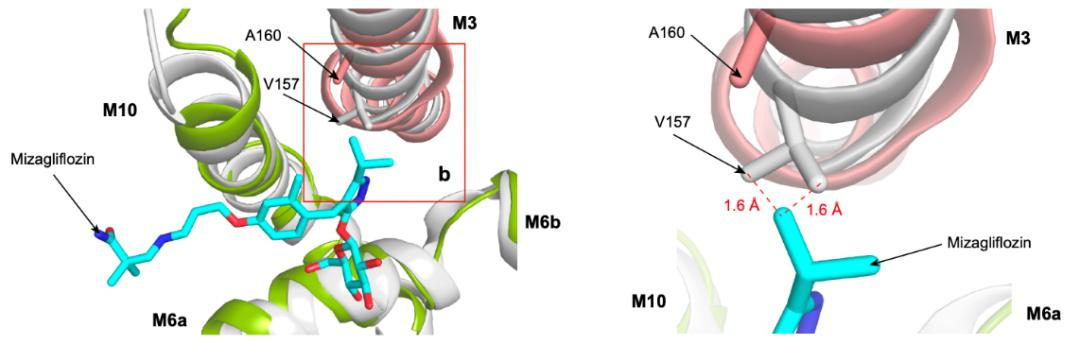
图3 抑制剂mizagliflozin与SGLT2的V157之间存在空间位阻
同时,由于SGLT1也可以作为水通道发挥作用,作者们也对抑制状态下的SGLT1结构进行了水通道的计算,结果发现在被抑制剂抑制的状态下,SGLT1中的水通道也被LX2761所阻塞,其通道大小无法通过水分子。
结合先前发表的无配体结合状态的SGLT1的结构,作者们也将向内开放的SGLT1与向外开放的SGLT1结构进行了比对,描绘了SGLT1在开放和关闭状态之间的构象变化。其中,作者们发现有些螺旋的位置基本不发生变化,即TM1,2,6,7,11,12,13,作者把这些螺旋命名为恒定模块(constant module);其他螺旋则发生较大的构象变化,包括TM0,3,4,5,8,9,10,这些螺旋被命名为运动模块(moving module)。其中,TM10上F453的运动介导了胞外门控的开放,TM3上的Y290介导了胞内门控的开放(图4)。
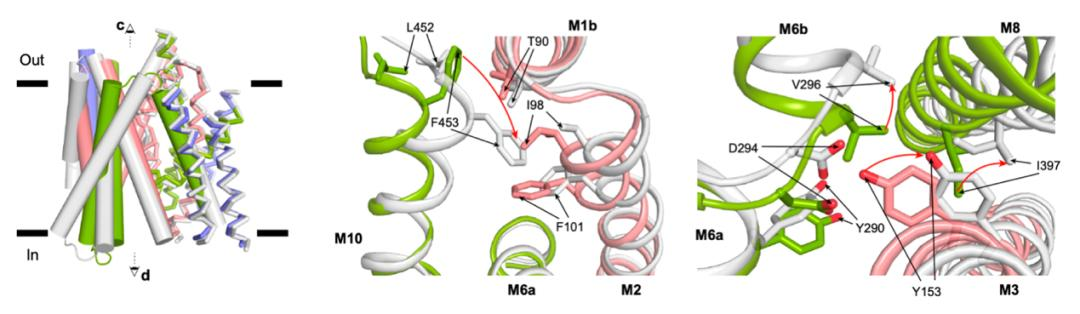
图4 SGLT1在门控区域的构象变化
综上所述,作者通过冷冻电镜对SGLT1-MAP17复合物和抑制剂的结构进行解析,发现抑制剂将SGLT1锁定在向外开放状态,确定了SGLT1抑制剂的结合位点和结合模式,在一定程度上解释了SGLT1选择性抑制剂的机制,为进一步优化SGLT1和SGLT2特异性抑制剂提供了结构基础。
北京大学未来技术学院分子医学所博士研究生牛延革和崔文浩为本论文的共同第一作者,博士生刘锐参与了数据收集工作,陈雷研究员为论文的通讯作者。该工作中的抑制剂合成和分子动力学模拟部分由北京大学化学院雷晓光教授及其博士生王三山和柯瀚完成。该工作冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台完成,得到了李雪梅、郭振玺、秦昌东、裴霞和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。该课题得到科技部和国家自然科学基金等经费支持。
文章链接:
https://www.nature.com/articles/s41467-022-33421-7