Nature | 陈雷组在nature杂志报道降糖药恩格列净的结构机制
葡萄糖是地球上绝大多数生物最重要的能量来源之一。葡萄糖经血液循环被运输至身体各个器官。在血液流经肾脏时,绝大部分葡萄糖会被滤出,然后再被重吸收回血液。肾脏每天重吸收的葡萄糖达到180g,才保证了最终排出的尿液中不含葡萄糖。因此,肾脏是维持血浆中葡萄糖水平的重要器官。
肾脏中负责葡萄糖重吸收的主要蛋白为钠-葡萄糖共转运蛋白(SGLT),其属于溶质载体转运子超家族5A(solute carrier transporter 5A)中的一员,与GLUT(SLC2A)截然不同。SGLT蛋白利用钠离子的电化学势驱动葡萄糖逆浓度梯度转运。因此,在转运葡萄糖的同时,伴随着钠离子的生电转运。在人类中,SGLT 共发现有六种亚型,其中在肾脏中主要起作用的为SGLT1和SGLT2。SGLT2 位于肾脏近曲小管的S1和S2节段,负责原尿中90%葡萄糖的重吸收,并且其活性依赖于附属亚基MAP17 。SGLT1 位于近曲小管 S3 节段,负责残余葡萄糖的重吸收。SGLT2的失活突变会引起家族性肾性尿糖,这类患者除了尿糖高以外没有其他明显的临床症状。此外,早在1886年,德国药学家约瑟夫冯梅林发现从苹果树根皮中萃取的天然产物根皮苷(Phlorizin)可以使动物多尿、排出尿糖、减轻体重。随后的研究发现:根皮苷就是SGLT的天然抑制剂。上世纪80年代末,90年代初,编码负责葡萄糖重吸收的SGLT1和SGLT2蛋白的基因也先后被克隆出来。这一系列在基础研究方面的进展促使制药界开始关注SGLT2抑制剂的开发。其理念是希望通过抑制SGLT蛋白的功能,使原尿中的葡萄糖无法被重吸收,从而通过尿液排出体外,达到间接降血糖的目的。与SGLT2相比,SGLT1 在肾脏中仅负责重吸收小部分葡萄糖,并且还在肠道中负责葡萄糖的摄取,抑制其功能后的降糖效果和副作用有待进一步研究。所以SGLT2成为治疗糖尿病的重要小分子药物靶点之一。
基于天然产物根皮苷的结构,目前,已有多种SGLT2的特异性抑制剂被成功开发出来,并应用于临床用于治疗2型糖尿病,比如恩格列净(Empagliflozin)、卡格列净(Canagliflozin)、达格列净(Dapagliflozin)等,其中恩格列净对SGLT2的选择性是SGLT1的2500倍。这些药物降糖疗效显著,验证了“通过尿出糖来降血糖”这一治疗思路的正确性。除了降血糖的功能外,这三种SGLT2的抑制剂还有治疗心衰、肾脏保护等多种临床效果,被誉为“神药”。尽管SGLT2抑制剂在2型糖尿病的治疗中具有重要价值,目前仍不清楚这些药物是如何抑制SGLT2蛋白功能的。
2021年12月8日,北京大学未来技术学院分子医学研究所陈雷课题组在Nature杂志发表题目为 “Structural basis of inhibition of the human SGLT2-MAP17 glucose transporter” 的文章,报导了人源SGLT2-MAP17复合物与抑制剂恩格列净结合的结构。原文链接见:https://www.nature.com/articles/s41586-021-04212-9。在该项研究中,课题组成员经过多年积累和摸索,创新性地采用“三接头固定”的策略克服了该复合物分子量较小的技术难题,获得了分辨率为2.95Å的冷冻电镜结构。结构显示抑制剂恩格列净结合在SGLT2蛋白的中间,抑制剂的葡萄糖基占据了葡萄糖的结合位点,葡萄糖基的羟基与SGLT2的氨基酸发生了极性相互作用。抑制剂的糖苷配基从葡萄糖结合位点往外延伸,直到蛋白外侧,将SGLT2锁定在向外开放状态。该工作确定了SGLT2抑制剂的结合位点,阐释了抑制剂抑制SGLT2的工作机制,为SGLT家族抑制剂的进一步优化提供了结构基础。
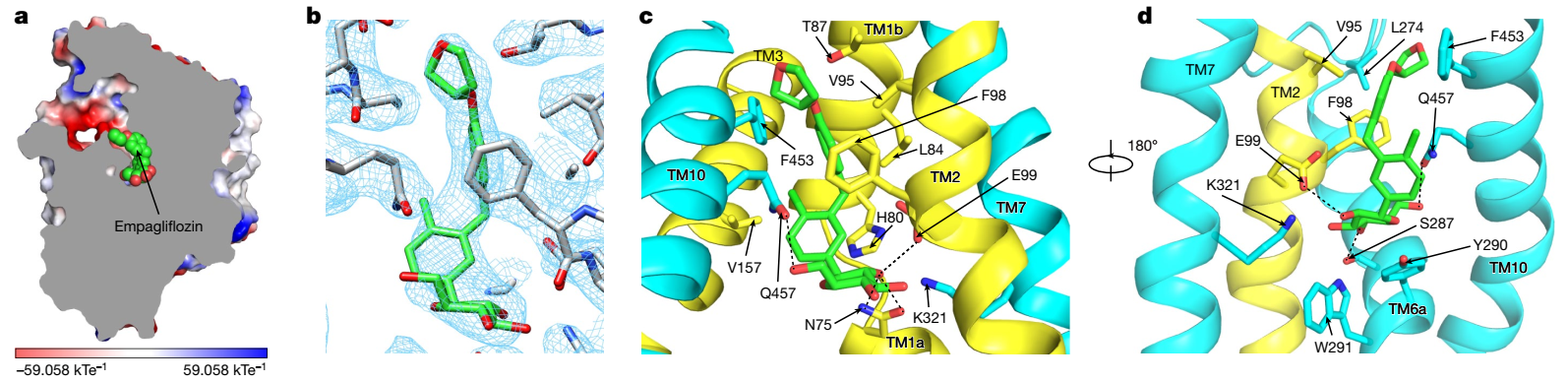
图1:SGLT2与恩格列净的作用模式
北京大学未来技术学院分子医学所博士研究生牛延革为本论文的第一作者,陈雷研究员为论文的通讯作者。该研究还得到陈雷课题组的博士生刘锐和博士后管成成,北京大学未来技术学院陈知行研究员及其博士生张源利用精湛的荧光标记技术,为本课题提供了高纯度荧光标记的葡萄糖底物。勃林格殷格翰药业有限公司(Boehringer-Ingelheim Pharma, GmbH & Co KG)的Stefan Hoerer和Herbert Nar为本课题提供了恩格列净及其同位素标记物。在该课题开展过程中,勃林格殷格翰中国分公司的张巍怡和叶俊青给予了大力协助。该工作冷冻电镜样品制备、筛选和采集在北京大学电镜平台和冷冻电镜平台完成,得到了李雪梅、郭振玺、邵博、裴霞和王国鹏等人的帮助。台湾大学的许丽卿(Lih-Ching Hsu)教授馈赠了1-NBDG样品用于课题的前期摸索。同位素实验由北京大学生科院的黄士堂协助完成。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。博士后管成成受到了勃林格殷格翰公司博士后项目的支持;该课题得到国家自然科学基金等经费支持。
陈雷实验室长期致力于代谢类疾病和心血管疾病药物靶点的工作机制,先后解析了胰岛细胞葡萄糖感受器KATP,一氧化氮受体sGC等重要蛋白的结构。
参考文献:
1 DeFronzo, R. A., Norton, L. & Abdul-Ghani, M. Renal, metabolic and cardiovascular considerations of SGLT2 inhibition. Nat Rev Nephrol 13, 11-26, doi:10.1038/nrneph.2016.170 (2017).
2 Wright, E. M., Loo, D. D. & Hirayama, B. A. Biology of human sodium glucose transporters. Physiol. Rev. 91, 733-794, doi:10.1152/physrev.00055.2009 (2011).
3 Kanai, Y., Lee, W. S., You, G., Brown, D. & Hediger, M. A. The human kidney low affinity Na+/glucose cotransporter SGLT2. Delineation of the major renal reabsorptive mechanism for D-glucose. J. Clin. Invest. 93, 397-404, doi:10.1172/JCI116972 (1994).
4 Coady, M. J. et al. MAP17 Is a Necessary Activator of Renal Na+/Glucose Cotransporter SGLT2. J. Am. Soc. Nephrol. 28, 85-93, doi:10.1681/ASN.2015111282 (2017).
5 Hediger, M. A., Coady, M. J., Ikeda, T. S. & Wright, E. M. Expression cloning and cDNA sequencing of the Na+/glucose co-transporter. Nature 330, 379-381, doi:10.1038/330379a0 (1987).
6 Wells, R. G. et al. Cloning of a human kidney cDNA with similarity to the sodium-glucose cotransporter. Am. J. Physiol. 263, F459-465, doi:10.1152/ajprenal.1992.263.3.F459 (1992).
7 Gorboulev, V. et al. Na+-D-glucose Cotransporter SGLT1 is Pivotal for Intestinal Glucose-Absorption and Glucose-Dependent Incretin Secretion. Diabetes 61, 187-196, doi:10.2337/db11-1029 (2012).
8 Genuardi, M. V. & Mather, P. J. The dawn of the four-drug era? SGLT2 inhibition in heart failure with reduced ejection fraction. Ther Adv Cardiovasc Dis 15, 17539447211002678, doi:10.1177/17539447211002678 (2021).
9 Williams, D. M., Nawaz, A. & Evans, M. Sodium-Glucose Co-Transporter 2 (SGLT2) Inhibitors: Are They All the Same? A Narrative Review of Cardiovascular Outcome Trials. Diabetes Ther 12, 55-70, doi:10.1007/s13300-020-00951-6 (2021).
10 Zinman, B. et al. Empagliflozin, Cardiovascular Outcomes, and Mortality in Type 2 Diabetes. N. Engl. J. Med. 373, 2117-2128, doi:10.1056/NEJMoa1504720 (2015).


