Nature | 陈雷课题组报道吞噬细胞NADPH氧化酶激活机制
日期:2024-02-15 | 点击量:
早在1932年,人们就发现白细胞在吞噬细菌的过程中会消耗大量氧气
【1】
,这一过程被称为“呼吸爆发”。1957年,临床医生在幼儿中确定了一种可遗传的先天性免疫缺陷病——慢性肉芽肿
(chronic granulomatous disease,
CGD
)
【2】
,该病患者会遭受复发性重度细菌与真菌感染,导致感染处肉芽肿的产生。进一步的研究发现这些病人的中性粒细胞虽然能够吞噬病原体,但缺少呼吸爆发过程,也不能有效地杀灭其吞噬的病原体
【3】
。随后几十年的研究表明吞噬细胞的呼吸爆发是由NADPH氧化酶2
(NOX2)
复合体介导的氧气还原过程
【4】
。吞噬细胞NADPH氧化酶全酶由两个组分构成,一个是由膜蛋白NOX2和p22形成的膜组分,另一个是由p47、p67、Rac和 p40形成的胞浆组分。在静息状态下,膜组分本身不具有活力;而当有病原信号刺激时,吞噬细胞会进行一系列的信号传导,使胞浆组分的p47等蛋白磷酸化,解除其自抑制的状态,从而使p47结合膜组分,同时招募p67、Rac1、p40蛋白至膜组分并最终激活NOX2蛋白。活化的NOX2蛋白会将胞浆中NADPH上的电子跨膜传递给吞噬小泡里的氧气,使其还原而生成超氧阴离子,导致氧气的快速消耗,发生呼吸爆发
【5】
。NOX2产生的超氧阴离子会进一步在SOD和MPO等酶的催化下产生更具杀伤活力的过氧化氢、次氯酸等物质,用于杀灭包裹在吞噬小泡里的病原体。
虽然吞噬细胞NADPH氧化酶在天然免疫中具有极其重要的功能,但其结构机制研究相对滞后。陈雷课题组于2022年在eLife杂志报道了NOX2-p22复合体在静息状态下的完整结构
【6】
。同年Genentech公司的课题组在Nature Communications杂志报道了NOX2-p22跨膜区
(TMD)
的结构
【7】
。然而这些结构中都不含有胞浆组分,胞浆组分激活吞噬细胞NADPH氧化酶膜组分的分子机制仍悬而未决。
2024年2月14日,北京大学未来技术学院分子医学研究所陈雷课题组在Nature杂志发表题目为
Structure of human phagocyte NADPH oxidase in the activated state
的文章,
报道了人源吞噬细胞NADPH氧化酶处于激活状态和静息状态的高分辨率冷冻电镜结构。
在NOX2早期的研究中常将胞浆组分p47、p67和Rac1的有效片段设计成融合蛋白用于NOX2的体外激活,但由于该融合蛋白亲和力较低,在电镜样品中难以和NOX2膜组分有效结合,从而导致胞浆组分的电子密度难以被捕获。为了解决这一问题,作者们一方面将GFP及其纳米抗体
(GFPnb)
分别融合在p22和胞浆组分上以提高它们之间的亲和力,另一方面对p47、p67和Rac1之间连接序列的长度及其排列方式进行了优化,最终选择将p22-GFP-p67融合蛋白与NOX2共表达,所形成的复合体能够被脂修饰的GFPnb-p47-Rac1
(稳定结合GTP的Q61L突变体)
有效激活,具有较高的NADPH氧化酶活力。作者们最终在同一套冷冻电镜数据中通过三维分类同时获得了处于激活状态并包含有胞浆组分的NOX2的电子密度
(2.79 Å)
以及处于静息状态下不含有胞浆组分的NOX2电子密度
(2.99 Å)
。
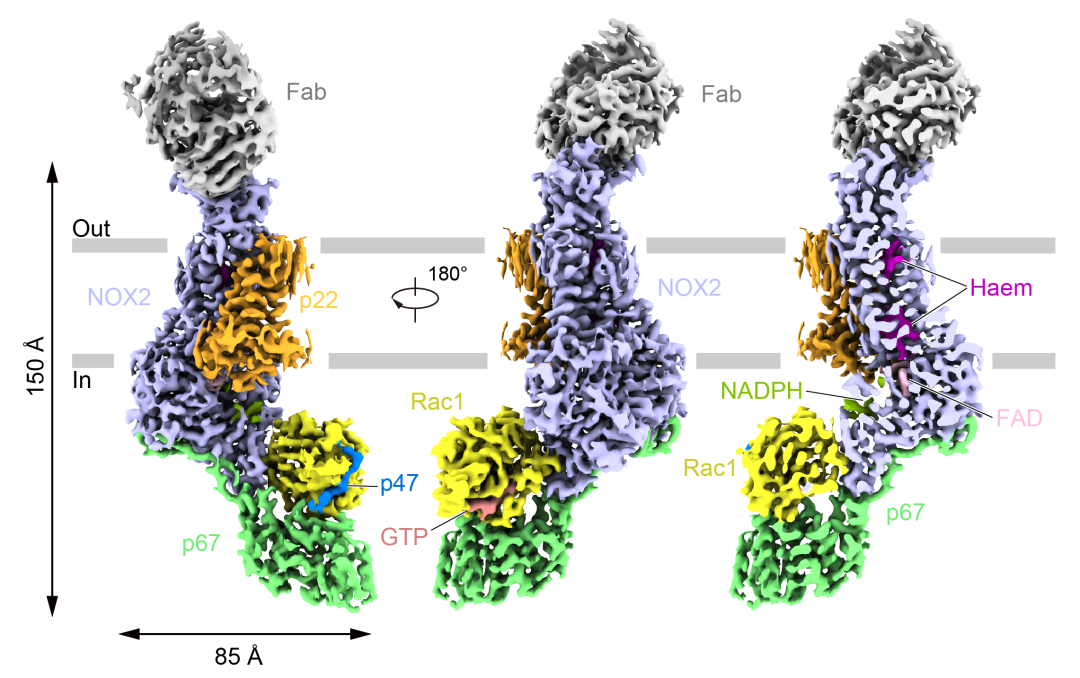
电子密度显示:激活状态的NOX2胞内侧与胞浆组分p67、Rac1和p47结合,其中跨膜结构域为NOX家族经典的六跨膜螺旋结构,p67和Rac1组成一个近似“嘴巴”的形状,p67代表“下颌”,Rac1代表“上颌”,两者通过氨基酸相互作用夹住NOX2的脱氢酶结构域
(DH)
。此外,p47上的一段小肽结合在Rac1 α1和β2之间的裂缝中。
p67与DH的结合主要依靠p67 C端向外伸出的激活结构域,第202-208位氨基酸形成的β折叠与NOX2的β1形成反平行式排列,与NOX2结合的Rac1处于GTP结合的状态。DH与p67和Rac1相互作用界面上的部分氨基酸突变会降低NOX2的活力。同时,数个在CGD患者中发现的突变位点也位于该相互作用界面附近,这进一步说明了该相互作用界面对NOX2的激活至关重要。
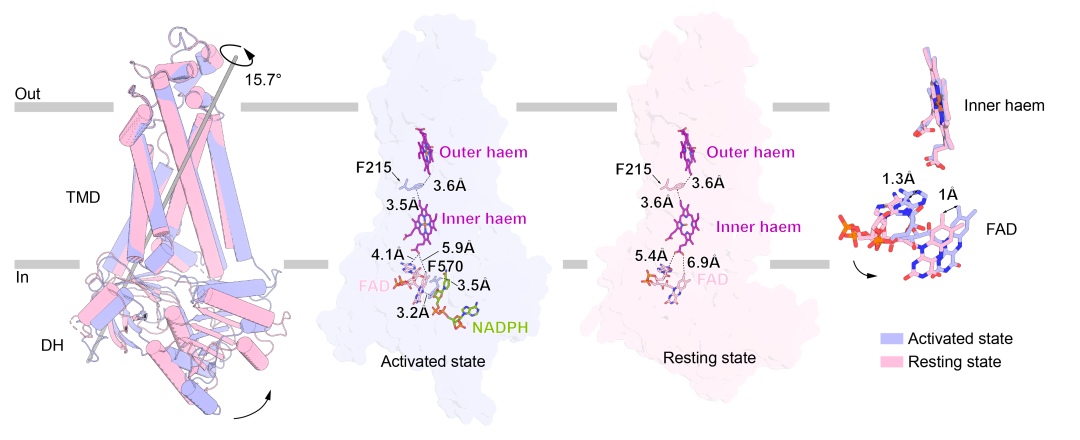
通过比较静息态结构和激活态结构,作者们发现:在胞浆组分结合后,NOX2的DH结构域会对接到TMD的底部并与TMD的N端形成相互作用。NADPH结合在DH暴露在外侧的裂缝中,其腺嘌呤基团和磷酸基团和裂缝周围的氨基酸发生了相互作用。
NOX2的TMD在激活前后没有明显的构象变化,而DH结构域相较于TMD转动了15.7°,形成一种更为紧凑的构象,也缩短了FAD与近胞质侧血红素之间的距离。FAD结合结构域
(FBD)
相对于NADPH结合结构域
(NBD)
产生了17.4°的旋转,并缩短了FBD和NBD的距离,使位于FBD上的R356靠近NADPH,与其形成相互作用,稳定了NADPH的结合。
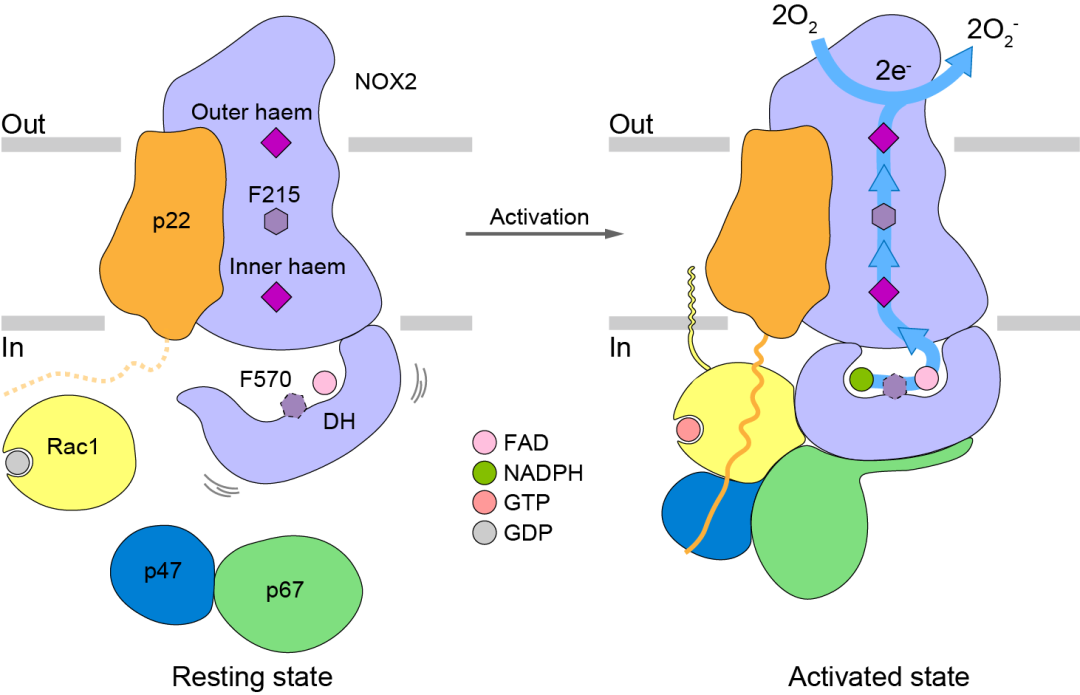
通过比较静息和激活两种状态下的NOX2的构象,作者们发现在胞浆组分组装后,p67-Rac1的结合会导致DH结构域的收缩并对接到TMD上,从而稳定NADPH的结合并将其电子经由FAD、近胞内侧血红素、F215和近胞外侧血红素传递到胞外的氧气,最终产生超氧阴离子。
综上所述,作者们
利用冷冻电镜对激活和静息状态下NOX2的结构进行了解析,从原子水平上观察到了胞浆组分p67、Rac1和p47是如何与NOX2结合并引起构象变化的,为深入理解NOX2的激活机制提供了结构基础。
北京大学前沿交叉学科研究院-生物医学跨学科研究中心博士生刘啸宇和未来技术学院博士生时亦廷、刘锐为本项工作的共同第一作者,未来技术学院博士生宋康成为该工作做出了重要贡献,陈雷研究员为论文通讯作者。已出站博士后吴惊香
(现协和药物所PI)
在课题开展的前期提供了重要支持。
https://www.nature.com/articles/s41586-024-07056-1