Immunity | 肖俊宇研究组与合作者揭示嗜乳脂蛋白激活γδ T细胞的“分子钳”机制
2025年6月11日,北京大学、昌平实验室肖俊宇研究组与张永辉研究组合作,在Immunity 杂志发表题为“Structures of butyrophilin multimers reveal a plier-like mechanism for Vγ9Vδ2 T cell receptor activation”的研究论文,系统揭示了这类γδ T细胞的识别机制:在靶细胞内部,BTN3A1与BTN2A1协同结合磷抗原,实现对胞内代谢变化的高效感知;在靶细胞表面,BTN3A2与BTN3A1形成异源二聚体,并与BTN2A1共同构建出“分子钳”结构——一侧钳住TCR的Vγ9链,另一侧结合Vδ2链的顶端区域,驱动TCR发生构象变化,最终实现激活。该研究为开发靶向γδ T细胞的免疫疗法提供了重要的结构基础和理论依据。
T细胞是免疫系统的核心组成部分,分为αβ T与γδ T两大亚群。其中,αβ T细胞通过识别MHC分子提呈的多肽抗原来激活免疫应答[1]。1984年发现的γδ T细胞,因其对肿瘤和病原体的快速响应能力,被认为是连接固有免疫与适应性免疫的桥梁。以人体外周血中最丰富的γδ T细胞亚群——Vγ9Vδ2 T细胞为例,它们通过感知靶细胞胞内代谢产物磷抗原(phosphoantigens, pAgs)信号实现对异常细胞的快速识别[2]。与依赖MHC分子呈递抗原的αβ T细胞不同,γδ T细胞的激活由嗜乳脂蛋白(butyrophilin, BTN)家族介导[3]。BTN家族的大多数成员主要由胞外类似于免疫球蛋白可变区(IgV)和恒定区(IgC)的结构域,跨膜(TM)和近膜(JM)区共同形成的coiled-coil区域,和胞内的B30.2/SPRY结构域组成[4]。在BTN家族成员中,BTN3A1、BTN3A2、BTN3A3和BTN2A1已被证明在识别pAgs和激活Vγ9Vδ2 T细胞中发挥作用。清华大学张永辉教授和其他团队的先前研究表明,BTN3A1通过胞内B30.2结构域结合磷抗原[5,6],形成的复合界面促进了与BTN2A1 B30.2的相互作用并介导由内而外(inside-out)的免疫激活[7]。在胞外,之前研究表明BTN2A1的胞外区能够与TCR Vγ9链的胚系编码区结合[8],但BTN3A1的胞外区是否与TCR结合仍存在争议[5];这些BTN分子如何组装成功能性复合体并精确调控T细胞应答,更是该领域亟待解决的重要科学问题。
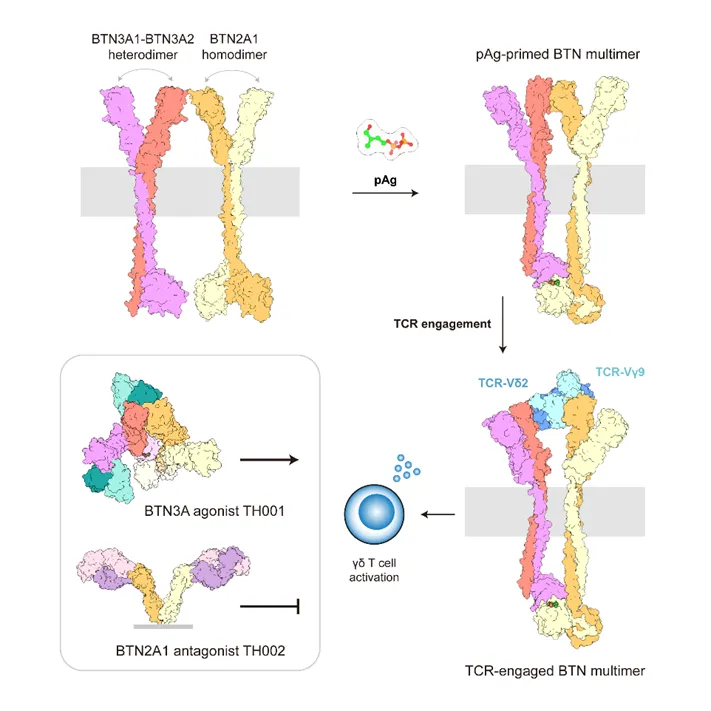
图1. 研究内容总结。BTN多聚体感知磷抗原促进Vγ9Vδ2 TCR结合和T细胞激活,靶向BTN3A的抗体TH001或靶向BTN2A1的抗体TH002可以分别促进和抑制激活。
研究团队首先解析了磷抗原HMBPP(4-羟基-3-甲基-2-烯基焦磷酸)结合状态下全长BTN3A1-BTN3A2–BTN2A1多聚体及其与Vγ9Vδ2 TCR复合物的高分辨率冷冻电镜结构。研究发现,磷抗原HMBPP的存在稳定了BTN3A1-BTN3A2与BTN2A1形成的1:1:2四聚体复合物,BTN3A2和BTN2A1胞外区通过IgV结构域的CFG面结合,遮蔽BTN2A1的TCR结合位点。细胞实验表明,破坏二者结合的BTN3A-IgV突变(如E35A、E106A)和BTN2A1-IgV突变(如E35A、R56A、E59A)能显著增强Vγ9Vδ2 T细胞的激活。
当TCR结合时,BTN多聚体发生旋转构象变化,解离的BTN3A2与BTN2A1胞外区形成双“钳臂”,分别结合TCR的不同区域。BTN2A1结合TCR Vγ9链侧面的胚系编码区域ABED面;BTN3A2被确认为领域内长期寻找的“第二配体”——它占据了TCR顶部,不仅结合Vδ2链的胚系编码区域(CDR1δ/CDR2δ/HV4δ),也结合克隆特异性的CDR3δ环(Leu97δ)和Vγ9链的CDR3γ环(Glu105γ/Lys108γ)。
该研究揭示的这一独特“钳式抓握”双配体识别机制与已报道的αβ TCR–配体识别机制截然不同。随后,为了进一步探究BTN–TCR相互作用的重要性,团队根据界面关键残基设计BTN3A2、BTN2A1和TCR蛋白的突变位点进行T细胞激活实验,并结合先前表位定位研究数据进行整合分析,结果表明关键残基的突变多数可以削弱或消除T细胞的激活。这在分子和细胞层面阐明了γδ T细胞的双重免疫特性:既通过胚系编码区域介导快速的固有免疫响应,又通过互补决定区(CDR3)介导特异性的适应性免疫识别。
研究团队还开发了高活性的BTN3A激动型抗体TH001以及BTN2A拮抗型抗体TH002,并解析了这两种抗体与BTN蛋白形成复合物的结构。TH001与已开发的抗体ICT01相比,具有更高亲和力和促进T细胞对肿瘤细胞的杀伤效果;与抗体20.1相比,占据了更多的BTN3A表位。TH002则通过阻断BTN2A1的TCR结合表位抑制T细胞激活。这不仅有助于进一步阐明γδ T细胞的激活机制,也有望应用于实体瘤治疗和自身免疫病干预。
值得一提的是,这项研究与哈尔滨工业大学黄志伟教授团队于2025年5月在Immunity 杂志发表的研究成果相互印证,共同增进了对BTN多聚体复合物形成和γδ T细胞活性调控的理解。
北京大学生命科学学院2022级博士研究生张迈、北京大学前沿交叉学科研究院2023级博士研究生王一晴(PTN项目)、苏州大学第一附属医院蔡宁宁、清华大学药学院2023级博士研究生屈莹莹为论文的共同第一作者。张永辉教授(清华大学药学院、清华-北大生命科学联合中心、北京生物结构前沿研究中心)和肖俊宇教授(基因功能研究与操控全国重点实验室、北京大学生命科学学院、北大-清华生命科学联合中心、昌平实验室)为论文的共同通讯作者。清华大学马先强、苏州大学附属第一医院张学光教授等为该研究也做出了重要贡献。
该研究得到了国家自然科学基金、国家重点研发计划、昌平实验室、北京大学生命科学学院启东产业创新基金等项目的资助。北京大学冷冻电镜平台、昌平实验室冷冻电镜平台、清华大学生物样品制备与鉴定平台、北京大学生命科学学院仪器中心、清华大学蛋白质研究技术中心为该研究提供了有力保障。
参考文献:
[1] Rossjohn, J., Gras, S., Miles, J.J., Turner, S.J., Godfrey, D.I., and McCluskey, J. (2015). T cell antigen receptor recognition of antigen-presenting molecules. Annu. Rev. Immunol. 33, 169-200. https://doi.org:10.1146/annurev-immunol-032414-112334
[2] Tyler, C.J., Doherty, D.G., Moser, B., and Eberl, M. (2015). Human Vγ9/Vδ2 T cells: Innate adaptors of the immune system. Cell. Immunol. 296, 10-21. https://doi.org:10.1016/j.cellimm.2015.01.008
[3] Vantourout, P., Laing, A., Woodward, M.J., Zlatareva, I., Apolonia, L., Jones, A.W., Snijders, A.P., Malim, M.H., and Hayday, A.C. (2018). Heteromeric interactions regulate butyrophilin (BTN) and BTN-like molecules governing γδ T cell biology. Proc. Natl. Acad. Sci. USA 115, 1039-1044. https://doi.org:10.1073/pnas.1701237115
[4] Arnett, H.A., and Viney, J.L. (2014). Immune modulation by butyrophilins. Nat. Rev. Immunol. 14, 559-569. https://doi.org:10.1038/nri3715
[5] Sandstrom, A., Peigné, C.-M., Léger, A., Crooks, James E., Konczak, F., Gesnel, M.-C., Breathnach, R., Bonneville, M., Scotet, E., and Adams, Erin J. (2014). The intracellular B30.2 domain of butyrophilin 3A1 binds phosphoantigens to mediate activation of human Vγ9Vδ2 T cells. Immunity 40, 490-500. https://doi.org:10.1016/j.immuni.2014.03.003
[6] Yang, Y., Li, L., Yuan, L., Zhou, X., Duan, J., Xiao, H., Cai, N., Han, S., Ma, X., Liu, W., et al. (2019). A structural change in butyrophilin upon phosphoantigen binding underlies phosphoantigen-mediated Vγ9Vδ2 T cell activation. Immunity 50, 1043-1053.e1045. https://doi.org:10.1016/j.immuni.2019.02.016
[7] Yuan, L., Ma, X., Yang, Y., Qu, Y., Li, X., Zhu, X., Ma, W., Duan, J., Xue, J., Yang, H., et al. (2023). Phosphoantigens glue butyrophilin 3A1 and 2A1 to activate Vγ9Vδ2 T cells. Nature 621, 840-848. https://doi.org:10.1038/s41586-023-06525-3
[8] Fulford, T.S., Soliman, C., Castle, R.G., Rigau, M., Ruan, Z., Dolezal, O., Seneviratna, R., Brown, H.G., Hanssen, E., Hammet, A., et al. (2024). Vγ9Vδ2 T cells recognize butyrophilin 2A1 and 3A1 heteromers. Nat. Immunol. 25, 1355-1366. https://doi.org:10.1038/s41590-024-01892-z


