Protein & Cell | 李龙组解析重建于脂双层中磷脂翻转酶的高分辨率电镜结构
磷脂翻转酶(phospholipid flippase)通过水解ATP将磷脂分子从生物膜的胞外侧(包括细胞外侧以及细胞器的囊腔侧)转运到胞浆侧,在维持生物膜的磷脂不对称性分布中发挥重要作用【1】。磷脂翻转酶仅在真核生物中表达,属于P型ATP酶( P-type ATPase )超家族中的成员最多的P4-ATP酶亚家族,与CDC50蛋白家族形成寡聚体发挥功能。
不同的磷脂翻转酶对底物具有不同的偏好性。与其他P型ATP酶一样,磷脂翻转酶具有三个典型的胞质结构域:核苷酸结合结构域(N结构域,nucleotide binding domain)、磷酸化结构域(P结构域,phosphorylation domain)和执行结构域(A结构域,actuator domain)【2】。其中,N 结构域负责结合ATP并磷酸化邻近P结构域中高度保守的天冬氨酸残基, 而A结构域则负责将磷酸化的天冬氨酸残基去磷酸化。P型ATP酶转运底物的过程被称为Post-Albers循环,存在E1、E1P、E2P和E2四种状态。E1结合ATP后自身磷酸化成为具有较高能量的E1P,E1P会自发地转变为能量较低的E2P,E2P去磷酸化转变为E2,E2又会自发转变为E1开始下一个循环。绝大部分P-型ATP酶为阳离子转运蛋白(例如钙离子泵、钠钾离子泵以及氢离子泵),而磷脂翻转酶P4-ATP酶的转运底物为具有体积巨大、带负电性的磷酸基头部和很长的疏水尾部的磷脂分子。磷脂翻转酶转运底物的具体机制一直是这个领域的热点。
2019年6月Nature 首先报道了酵母磷脂翻转酶Drs2p-Cdc50p 在抑制、中度活化和完全活化状态下E2P构象的冷冻电镜结构,探讨了Drs2p-Cdc50p的自抑制及PI4P依赖激活的调控机制,并在此基础上提出了一个可能的磷脂进入位点【3】。接着在9月Science报道了人磷脂翻转酶ATP8A1-CDC50a 多个中间状态的冷冻电镜结构(其中在E2Pi-PL结构内部存在一个磷脂分子),然而这些中间状态的跨膜区结构总体保持变化不大【4】。由于以上结构都是在去垢剂环境下获得,而非天然脂双层结构中,因此不能很好地解释磷脂转运的过程。
2020年4月17日,北京大学李龙课题组在Protein & Cell杂志发表题为Structures of a P4-ATPase lipid flippase in lipid bilayers 的研究论文,报道了重建于脂双层中的磷脂翻转酶的高分辨率电镜结构,为磷脂转运的机制提供了新的线索。

他们利用酵母表达系统表达了嗜热毛壳菌(Chaetomium thermophilum)的磷脂翻转酶ctDnf1p-Cdc50p,并将其重建于模拟磷脂双分子层的nanodisc【5】中,通过添加BeF3-和AMPPCP稳定E2P和E1-ATP构象,利用冷冻电镜单颗粒分析技术获得分辨率分别为3.4 Å和3.5 Å的结构。在结构中存在两个磷脂结合位点,比较两个结构可以发现,跨膜螺旋TM1和TM2表现出高度的灵活性。
在E2P构象中,靠近胞外侧的磷脂分子所在的位置与Science所报道的E2Pi-PL结构相似,相比而言,磷脂头部更加深入蛋白内部,磷脂尾部弯曲将近90°。而靠近胞浆侧的磷脂分子已经完成了内翻的过程,其头部位于水-膜交界处,尾部的朝向垂直于膜平面。
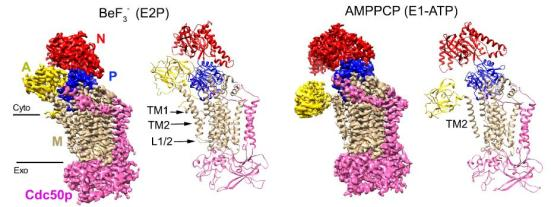
比较两个结构可以发现,不仅胞质结构域发生了很大的构象变化,跨膜区结构也有不同。在E1P-ATP构象中,跨膜螺旋TM1的电子密度不可见,表明在磷脂转运的过程中TM1存在高度的灵活性,很可能存在α螺旋与无序结构之间的转变。
此外,nanodisc的膜结构发生了局部凹陷。在E1P-ATP构象中,局部的膜厚度缩小了将近一半。这一现象也存在于磷脂外翻酶TMEM16F的结构中【6】,很可能是磷脂转运过程中的一种共同机制。
综上,重建于nanodisc中的蛋白结构更接近磷脂翻转酶的天然状态,包含了新的磷脂结合位点,提供了在去垢剂条件下不能获得的膜-蛋白相互作用的信息,为磷脂转运的具体机制提供了重要的线索。
原文链接:https://link.springer.com/article/10.1007/s13238-020-00712-y