Cell | 高宁/李宁宁团队揭示血红细胞Spectrin-Actin膜骨架系统的组织规则及结构稳定性的分子基础
经典的细胞骨架是由微管(microtubule)、微丝(F-actin)或者中间丝组成的三维网络结构,在细胞的稳定性维持、胞内物质运输以及细胞运动方面发挥关键作用。除此之外,动物细胞中还存在一种以血影蛋白spectrin为基础的二维网状形式的膜骨架系统。膜骨架平行于细胞膜分布,紧贴在细胞膜内侧,赋予细胞膜更高的机械强度和可塑性 (Lux, 2016)(图1)。膜骨架与细胞膜的功能活动密切关联:通过与膜蛋白的互作,膜骨架可以调控膜蛋白在细胞膜上的定位,促进膜蛋白聚簇形成高级组织形式,同时也参与调控细胞对外界信号的响应。上世纪60年代,膜骨架首先在红细胞中发现,针对膜骨架的分子层面的研究也多以红细胞为模型。随后在神经细胞、上皮细胞和淋巴细胞等多种细胞类型的细胞膜上也证实了膜骨架的存在及其功能的重要性。膜骨架在神经细胞中的组织形式和功能也有较多研究,在轴突起始段(axon initial segments)和郎氏结(nodes of Ranvier)的形成上起着关键作用。
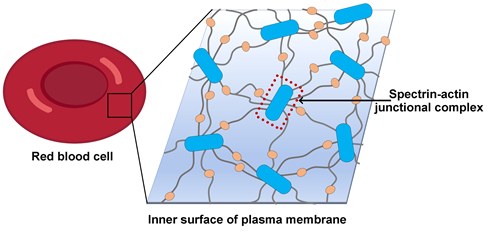
图1,红细胞膜骨架示意图
红细胞的膜骨架整体上呈现六边形为主的多边形二维网格结构,而在轴突细胞膜上,膜骨架沿着轴突以一维周期性网格(quasi-1D periodic lattice)的形式排布。这些网格以一种特异的短的F-actin为网格节点,以spectrin四聚体为网格线;每一个节点上,F-actin作为集线器连结多条spectrin纤维,将其汇聚到一起(图1)。多种F-actin结合蛋白进一步稳定这种连结并调控其功能,包括不同F-actin所通用的原肌球蛋白(tropomyosin)和原肌球调节蛋白(Tropomodulin,Tmod),以及膜骨架特异的adducin、protein 4.1(P4.1)和dematin等。这种由actin、spectrin及辅助因子组成的网格节点称为spectrin-actin junctional complex,是膜骨架的核心复合物。膜骨架主要通过两个位点与膜蛋白建立连接 (Lux, 2016; Mankelow et al., 2012):一是junctional complex通过P4.1、adducin、dematin与膜蛋白互作;二是在spectrin 纤维的中段,由另一种蛋白因子ankyrin与多种膜蛋白形成ankyrin complex (Bruce et al., 2003; Vallese et al., 2022; Xia et al., 2022)。
基于膜骨架在细胞膜的机械强度和代谢活动中的关键角色,其功能的紊乱与多种人类疾病密切相关 (An and Mohandas, 2008; Bennett and Healy, 2008)。Spectrin、ankyrin、P4.1等膜骨架组成因子的缺失或突变导致多种遗传性红细胞异常疾病的发生;Ankyrin-B功能缺失的突变与一种遗传性心律失常疾病直接相关,称为ankyrin-B综合征;Adducin的多种位点突变与高血压具有高度的关联性;此外,β-III-spectrin会导致一种遗传性的神经退行性疾病,spinocerebellar ataxia type 5。关于膜骨架核心复合物junctional complex的成分组成的研究工作较多,但是这些因子的精确的分子角色和功能机制有待进一步的研究,同时也尚不能排除该复合物是否含有更多未知的组成因子。目前领域内对junctional complex的结构研究相对滞后,缺乏高分辨的结构信息,这很大程度上限制了对其组成因子功能角色的深入理解。

2023年4月11日,北京大学生命科学学院、生命科学联合中心高宁/李宁宁课题组在Cell期刊在线发表了题为“Structural basis of membrane skeleton organization in red blood cells”的研究论文。经过大量的条件优化,课题组成功从猪血红细胞中分离出了膜脂被完全清除、在冷冻电镜条件下具有较好分散度的膜骨架网格(图2),并对这一完整的内源膜骨架系统进行了冷冻电镜结构分析,最终获得了junctional complex的高分辨结构,揭示了junctional complex和膜骨架组装的分子细节,阐释了其组成因子在膜骨架组装和稳定性维持方面的分子机制。

图2,猪红细胞的膜骨架冷冻电镜原始成像图片(红色方框内为由多条spectrin纤维连接起来的两个临近的junctional complex)
从高分辨的三维结构中可以清楚地理解junctional complex的组织形式(图3)。junctional complex全长约42 nm,核心部分是由12个actin亚基组成的6层的F-actin。在第1层到第5层(图3中,从上到下)之间总共固定有8根spectrin 纤维。调控F-actin长度的Tmod单体和adducin四聚体分别扣在F-actin的两端(pointed end和barbed end),阻止F-actin的延长或解聚。此外两条tropomyosin coiled coil(TMCC)分别结合在F-actin的两侧,与Tmod和adducin也分别都有互相作用,三者共同决定了junctional complex的长度。在第2层到第5层之间,三个dematin分子以延展的结构环绕junctional complex的主干部分,与多个actin和spectrin亚基互作。从整体上来看,junctional complex的组成因子都分别与内部的多个亚基互作,构成了一个错综复杂的相互作用网络,共同维持了spectrin-actin连结的结构稳定性。关于junctional complex各个组分包括actin、spectrin、adducin的分子比例,此前也是领域争论的一个焦点,这项工作的结构部分也明确了各个组成因子在复合物中的化学计量比以及寡聚形式。
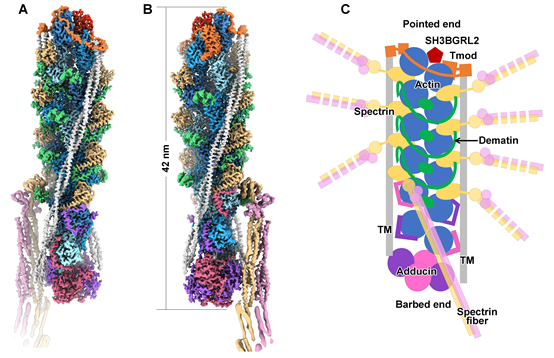
图3,Spectrin-actin junctional complex冷冻电镜结构
除此之外,这项工作还有多个重要的新发现:(1)从结构中鉴定了junctional complex的一个新的组成因子SH3BGRL2,同Tmod共同组成了一个完整的帽子结构结合在F-actin的pointed end,以维持F-actin的稳定性。该工作通过体内pull-down实验进一步验证了HEK293细胞的Tmod-F-actin复合物中也存在SH3BGRL2。结合已有的SH3BGRL2的研究数据,该工作的研究表明SH3BGRL2可能是F-actin系统通用的pointed end结合蛋白。(2)adducin作为一种F-actin的帽子蛋白,其四聚体的主体部分结合在F-actin的barbed end以维持复合物的稳定。但与此同时,adducin的N末端和C末端伸出四个类似触手的柔性序列分别结合在F-actin 的第5层和第6层上,与actin及spectrin互作。这一结构信息一方面解释了此前研究中发现的adducin促进spectrin和actin结合的功能,另一方面adducin的触手占据了第5层和第6层上的spectrin和dematin结合位点,从而构成了决定junctional complex上spectrin和dematin分子数量的一个关键因素。(3)在以往所有的F-actin结构中,tropomyosin主要通过与actin直接互作的方式对称地结合在F-actin两侧。但在junctional complex中,tropomyosin主要通过与spectrin、dematin、adducin互作间接地结合在F-actin纤维上,表明该工作发现了一种新的tropomyosin与F-actin的结合模式(图4)。
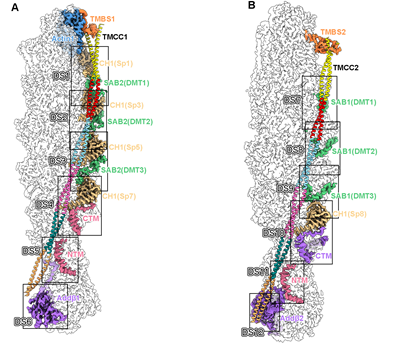
图4,Junctional complex中TMCC与F-actin间接结合
进一步的结构分析发现,junctional complex的组成元件存在多种层面的功能冗余性。(1)红细胞膜骨架主要呈六边形网格,但junctional complex却含有8条spectrin 纤维,即每个网格节点可以发出8条可用的网格线;(2)adducin四聚体共含有8条可结合actin的类似触手的柔性序列,但复合物中仅需要四条柔性序列的结合;(3)junctional complex的tropomyosin含有两种亚型,可以同二聚体或异二聚体的形式组成TMCC,降低了一种亚型异常对复合物稳定性带来的影响;(4)Dematin是稳定junctional complex的关键因子,复合物中结合有三个dematin分子,但却含有7个dematin 的C端 headpiece结构域的结合位点,有利于dematin的快速结合。这种多层次的冗余性可能是一种故障保险机制,保证了膜骨架组装的鲁棒性,并为膜骨架的变形提供了支持。
综上,该工作解析了红细胞膜骨架的核心复合物spectrin-actin junctional complex的高分辨结构,为理解膜骨架的组装和动态性以及其组成元件在膜骨架稳定和调控中的分子机制提供了一个结构框架。多个junctional complex的组成因子都属于通用性的F-actin结合蛋白,因此该工作的研究结果也为其它的F-actin系统提供了重要的结构和机制信息。此外,值得一提的是,膜骨架的样品极度不均一(图2),对颗粒挑选和高分辨结构计算都有很大的干扰,该工作的数据处理流程也为 “半纯化的”(semi-purified)的复杂生物样品的结构研究提供了一种新思路。
北京大学生命科学学院高宁教授和李宁宁副研究员为本文的共同通讯作者,李宁宁和前沿交叉学科研究院博士研究生陈思伊(昌平实验室研究生项目)为本文的共同第一作者。清华大学生命科学学院张强锋教授和课题组博士后徐魁、北京生命科学研究所董梦秋研究员和课题组博士生何梦婷也参与了这项工作。该研究得到了膜生物学国家重点实验室、北大-清华生命科学联合中心、昌平实验室、国家自然科学基金、国家重点研发计划、启东-SLS创新基金的支持。北京大学电镜实验室、冷冻电镜平台、高性能计算平台、生命科学学院仪器中心及国家蛋白质基础设施(北大分平台)对本项目提供了重要的技术支撑。
原文链接:https://www.cell.com/cell/fulltext/S0092-8674(23)00278-7
参考文献:
An, X., and Mohandas, N. (2008). Disorders of red cell membrane. Br J Haematol 141, 367-375.
Bennett, V., and Healy, J. (2008). Organizing the fluid membrane bilayer: diseases linked to spectrin and ankyrin. Trends in Molecular Medicine 14, 28-36.
Bruce, L.J., Beckmann, R., Ribeiro, M.L., Peters, L.L., Chasis, J.A., Delaunay, J., Mohandas, N., Anstee, D.J., and Tanner, M.J. (2003). A band 3-based macrocomplex of integral and peripheral proteins in the RBC membrane. Blood 101, 4180-4188.
Lux, S.E.t. (2016). Anatomy of the red cell membrane skeleton: unanswered questions. Blood 127, 187-199.
Mankelow, T.J., Satchwell, T.J., and Burton, N.M. (2012). Refined views of multi-protein complexes in the erythrocyte membrane. Blood Cells Mol Dis 49, 1-10.
Vallese, F., Kim, K., Yen, L.Y., Johnston, J.D., Noble, A.J., Cali, T., and Clarke, O.B. (2022). Architecture of the human erythrocyte ankyrin-1 complex. Nat Struct Mol Biol 29, 706-718.
Xia, X., Liu, S., and Zhou, Z.H. (2022). Structure, dynamics and assembly of the ankyrin complex on human red blood cell membrane. Nat Struct Mol Biol 29, 698-705.


