Nat Commun︱李丹/李雪明/刘聪合作报道帕金森病基因突变诱发特殊的纤维结构
α-突触核蛋白(αSyn)淀粉样纤维的聚集是帕金森病(PD)和突触核蛋白疾病的一种常见组织学特征【1-2】。
研究表明,αSyn淀粉样纤维能够作为prion-like种子进行繁殖;在αSyn病理环境下,可以在细胞间进行传播【3-4】。证据也显示,病理性αSyn纤维的传播与疾病的进展密切相关【5-6】。
αSyn编码基因SNCA的异常(包括点突、重复等)是多种家族性疾病的致病因子,且这些疾病具有广泛的独特临床特征【7-9】。在多种细胞和PD样动物模型中,相关遗传突变会加重疾病的病理【10】。
冷冻电镜(cryo-EM)研究提示,在家族性PD(fPD)中,αSyn的突变(包括E46K、A53T/E、G51D及H50Q)可能改变了纤维的结构,从而影响了αSyn淀粉样蛋白聚集和PD病理【11-12】。其中,E46K突变是早期fPD一个诱因,且在临床上,患者表现出快速的、严重的疾病进展【13】。
之前的研究已表明,E46K突变可以增强αSyn纤维形成和αSyn病理。而固态NMR研究则表明,E46K突变会导致纤维结构发生较大的构象变化【10、14】。
不同的纤维多态性可能提示了与不同神经退行性疾病亚型之间的病理学关系【15-16】。因此,多形态淀粉样纤维结构的揭示将有助于我们对淀粉样病理机制的理解,也有利于为疾病的诊断和治疗提供一定的参考。
在于2020年5月26日为Parkinson’s disease associated mutation E46K of α-synuclein triggers the formation of a distinct fibril structure为题在线发表在Nature Communications上的文章中,来自上海交通大学Bio-X研究所的李丹研究员、清华大学生命科学学院的李雪明研究员、以及中国科学院生物与化学交叉研究中心的刘聪研究员合作团队(刘聪组的在读研究生赵焜与李雪明组的李耀旺博士为共一作)报道了N端氨基乙酰化E46K突变αSyn的特殊cryo-EM结构。Ac-E46K可以引起αSyn整体结构上的重新排列;且不耐受于苛刻条件和蛋白酶裂解,而更倾向于形成具有更强播种能力的纤维碎片。这项工作为fPD中E46K突变致使严重病理提供了结构学见解,同时,也强调了静电相互作用在定义纤维多态性中的重要性。

本工作中,首先,为了充分研究E46K突变对αSyn纤维形成的影响,作者优先获得了αSyn全长且N端带有乙酰化修饰的E46K突变重组体(简称Ac-E46K)。在一定缓冲液条件下,Ac-E46K可以形成具有右手螺旋扭曲的独特淀粉样纤维结构,这不同于野生型(WT)αSyn和其他家族性αSyn突变的左手螺旋扭曲(图1)。这或许暗示了Ac-E46K的特殊性质与其不同疾病病理之间的关系。
紧接着,作者发现,较WT的αSyn纤维,Ac-E46K纤维的稳定性差,且Ac-E46K的预成型纤维(PFFs)更具有播种能力,即更倾向于促进αSyn纤维形成,也更容易被蛋白酶K所降解(图1e-f)。这些结果整体表明,E46K突变改变了αSyn纤维的形态和稳定性。因此,也提示了Ac-E46K可能是致使更强疾病病理的一个原因(图1)。
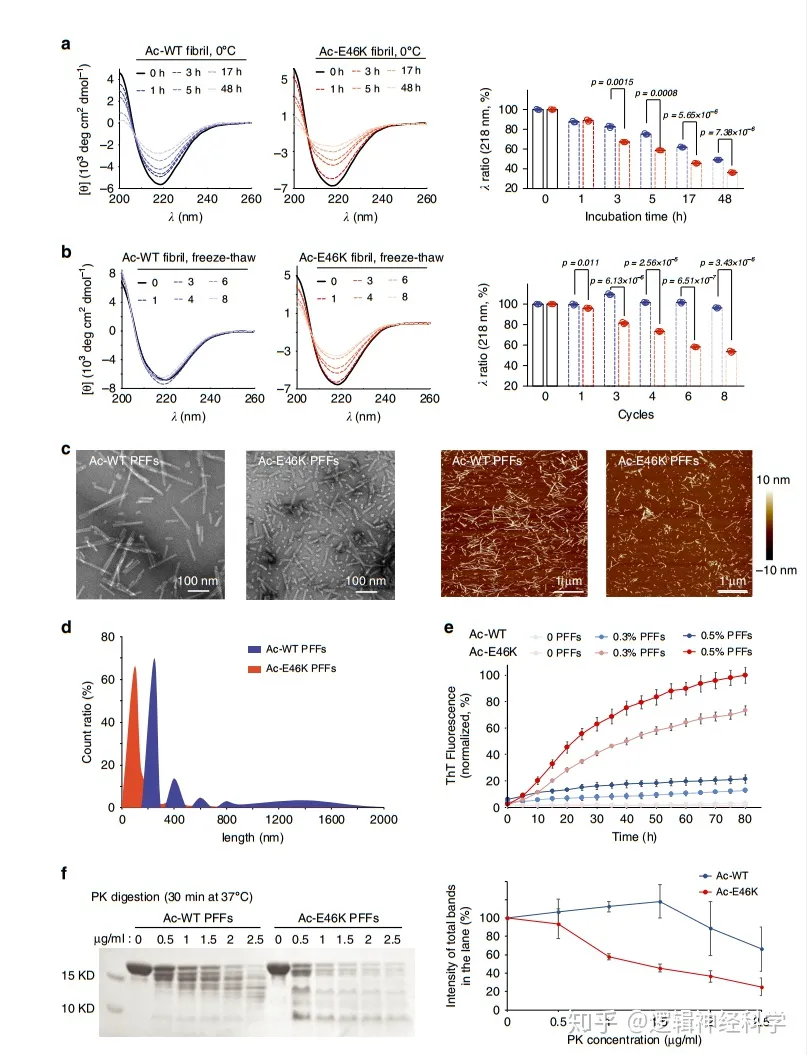
那么,鉴于上述发现,作者想进一步探究Ac-E46K纤维的特殊结构基础。于是,作者利用cryo-EM确定了Ac-E46K纤维的原子结构。cryo-EM密度图显示,Ac-E46K纤维呈右手螺旋,由两根缠绕在一起的原纤维(protofilament)组成,且呈假21螺旋对称性(图2)。这一密度图结果,有助于建立Ac-E46K纤维的原子结构模型(图3)。
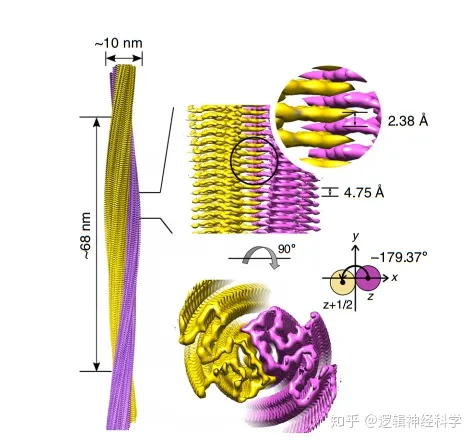
该结构模型则进一步显示,Ac-E46K纤维有一个由45- 99位氨基酸残基组成的略小的纤维核心,且纤维的N端和C端具有与WT一样的灵活性(图3a)。作者进一步发现,该纤维核心呈现出一定的蛇形折叠,且β链的拓扑结构不同于任何已报道的αSyn原纤维结构(图3b)。尤其是,核的N端区域具有明显的不同,即通过与C端T75、A76、 A78、及K80位点的相互作用,N端延伸并包含在C端区域(图3c)。
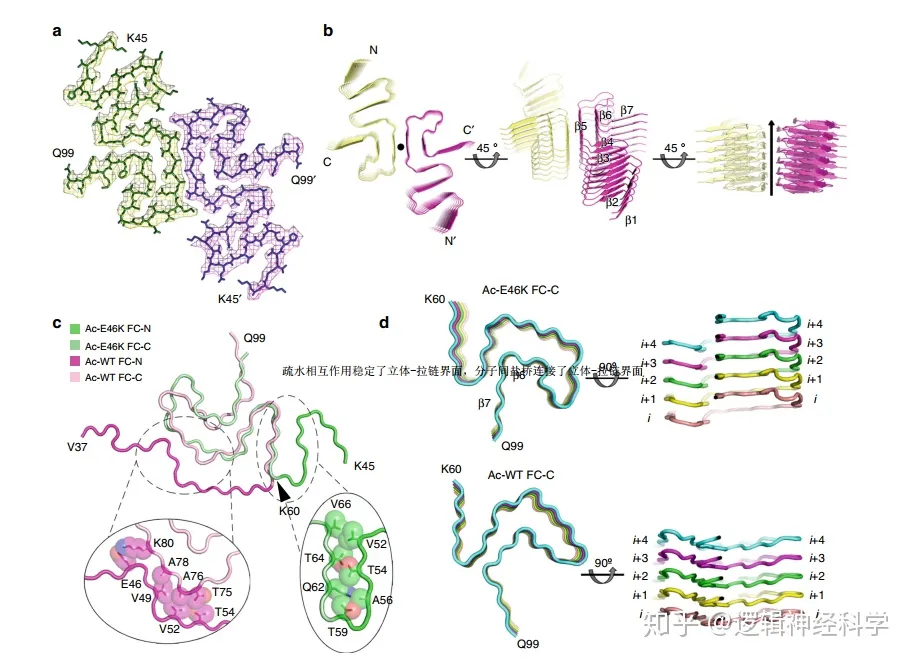
除了纤维核心的N端有较大的构象变化(/区别)之外,Ac-E46K和Ac-WT纤维的C端域虽然具有类似的拓扑结构,且呈Greek key样折叠,但是,两种片段的C端域的结构仍有较大差别:α位碳原子的均方根偏差较大,为5.558Å(1Å=10-10m)(图3d)。在Ac-WT纤维核心C端域,αSyn的子单元会折叠成一个平层;而在Ac-E46K纤维核心C端域,β6和β7则互换到下一层,进而形成内分子与侧链的相互作用(图3d)。
总之,这部分结果表明,Ac-E46K纤维具有独特的αSyn纤维折叠,即E46K突变完全改变了αSyn的纤维结构,使原来的(WT)结构发生了重排。
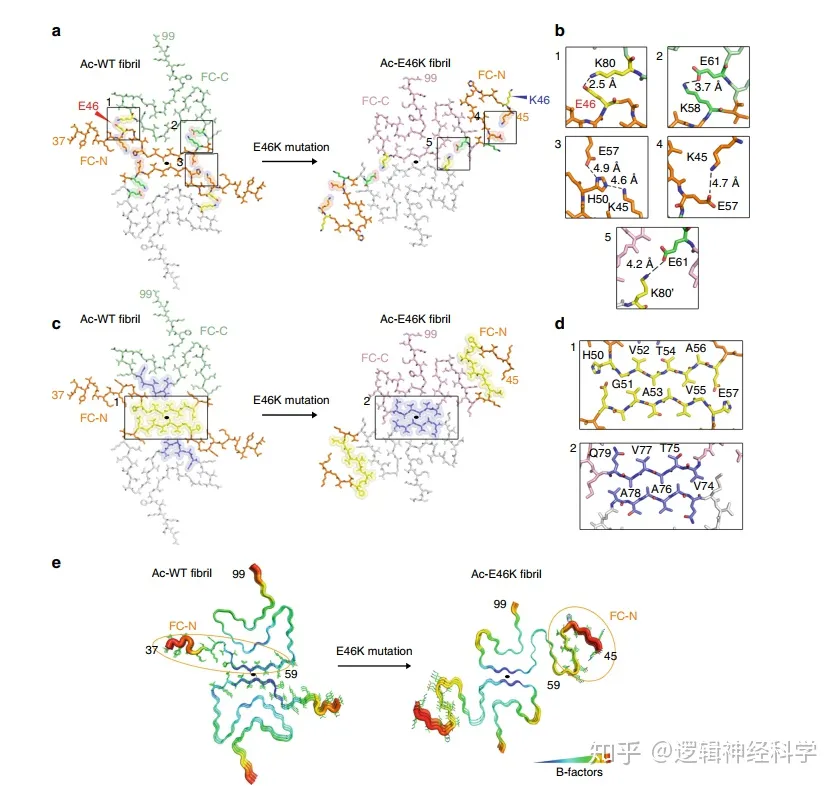
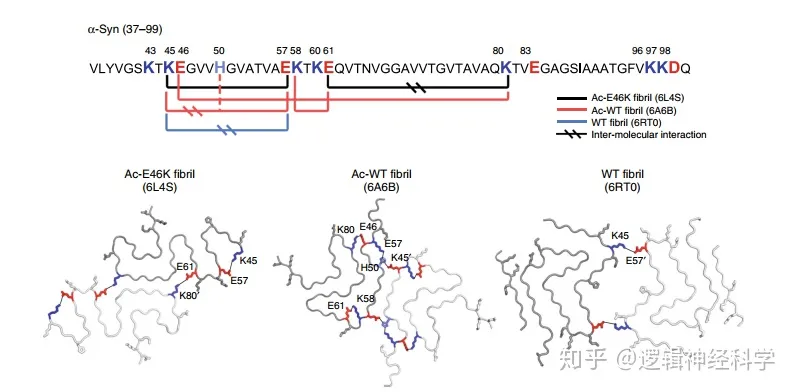
那么,鉴于E46K突变导致的这种结构上的重新排布,作者想再进一步了解WT和突变体中E46位点的具体功能。首先,作者发现,在Ac-WT纤维中,E46位点与K80位点相互作用,进而形成盐桥(salt bridge)(盐桥由氢键和离子键两种非共价相互作用所形成,有助于稳定蛋白结构),连同E61与K58之间的盐桥一起强化了纤维核心N端和C端之间的联系(即N端延伸并包含在C端区域)(图4a-b)。
其次,相比之下,在Ac-E46K纤维中,E46K突变则破坏E46-K80之间的盐桥,致使K58-E61和K45-H50-E57两个重要的静电相互作用被破坏(图4a-b)。而K45与E57之间的盐桥则稳定了定原纤维核N端域的β-发夹构象(图4a-b)。
而且,E46K突变也导致了WT原丝界面的破坏并形成了一种不同的原丝界面(图4c-d)。74-79位点之间的特定暴露片段则会在同型空间拉链结构(homo-steric zippers)中形成典型的I类并联来调节内部原丝的相互作用(图4b)。此外,侧链之间的疏水相互作用能够稳定空间拉链界面,分子间盐桥则进一步连接了这种空间拉链界面(图4a)。
最后,作者发现,在Ac-E46K纤维中,纤维核心N端域从纤维界面的释放,则增加了核的结构灵活性(图4c)。因此,Ac-WT纤维相比,Ac-E46K纤维的这种相对疏松的结构组装或许能够解释其纤维稳定性下降、对环境敏感性增加的原因。作者认为,这可能与家族性PD中αSyn突变导致的病理有关。
文章结论
这篇文章表明,不同的带电残基的组合可能是导致淀粉样纤维多态性的关键因素之一(图3-5)。
同时,这项工作为家族性PD中αSyn突变(比如E46K突变)致使αSyn相关疾病病理提供了结构学见解。
此外,此项研究也提示,基因突变、翻译后修饰以及辅助因子等可能进一步引起或强化了潜在的αSyn纤维结构的变化。
原文链接:
https://www.nature.com/articles/s41467-020-16386-3
https://www.https://www.nature.com/articles/s41467-020-16386-3467-020-16386-3


