Nature | 北大谢晓亮/曹云龙/肖俊宇与昌平实验室联合团队揭示新冠奥密克戎株新亚型的免疫逃逸特征
新冠疫情暴发已逾两年,病毒在全球肆虐的态势未见消退,对人类生活、健康产生严重影响,奥密克戎变异株BA.1、BA.2、BA.2.12.1、BA.4、BA.5的接连出现对疫苗接种的预防效果和抗体药物的治疗效果提出了严峻挑战,新变异株的受体结合能力和免疫逃逸能力亟待详尽研究。
北京大学生物医学前沿创新中心(BIOPIC)、昌平实验室谢晓亮/曹云龙课题组联合北京大学生命科学学院肖俊宇课题组、中国科学院生物物理所王祥喜课题组、中国食品药品检定研究院王佑春课题组、南开大学沈中阳课题组于2022年6月17日在《自然》杂志在线发表了题为BA.2.12.1, BA.4 and BA.5 escape antibodies elicited by Omicron infection的研究论文,发现奥密克戎突变株BA.2.12.1、BA.4、BA.5新亚型呈现出更强的免疫逃逸能力,并且对奥密克戎BA.1感染者康复后血浆出现了显著的中和逃逸现象。
研究人员通过高通量单细胞测序、分离并表征上千个新冠单克隆中和抗体后,发现奥密克戎BA.2.12.1、BA.4、BA.5进化出的新突变能够特异性逃逸BA.1感染所诱导产生的中和抗体。并且,奥密克戎BA.1感染存在“免疫原罪”现象,即BA.1感染主要唤起之前原始株疫苗所诱导的记忆B细胞,而很难产生特异性针对BA.1的中和抗体。这些发现提示,基于BA.1的奥密克戎疫苗可能已不适合作为现有免疫背景下的加强针,所诱导出的抗体对新变异株将不具有广谱保护效力。并且,由于新冠病毒存在“免疫原罪”现象并且可以快速进化出免疫逃逸突变位点,通过奥密克戎感染实现群体免疫是极难实现的。

本研究最早于2022年5月2日在线发布于bioRxiv预印本平台,是世界首篇系统性研究BA.2.12.1和BA.4/5刺突蛋白结构和体液免疫逃逸特性,揭示奥密克戎突变株“免疫原罪”分子机制的研究论文,在国际学术界引起了广泛关注,受到了Science、New York Times、ABC News等多家境外知名媒体的报道。
目前主要的奥密克戎变异株都具有较高的传播能力,为了研究其传播能力与刺突蛋白(Spike glycoprotein)构象和受体结合能力的关系,合作团队解析了奥密克戎变异株BA.2、BA.3、BA.2.12.1、BA.2.13以及BA.4/5刺突蛋白三聚体的冷冻电镜结构,并分别测定各突变体刺突蛋白或受体结合域(RBD)与hACE2的亲和力。结构分析表明,BA.4/5携带的F486V突变可能导致hACE2亲和力下降,但L452R和493Q回复突变降低了这一影响。研究结果显示BA.2.12.1、BA.2.13和 BA.4/5对hACE2的亲和力与BA.2相当(图1)。
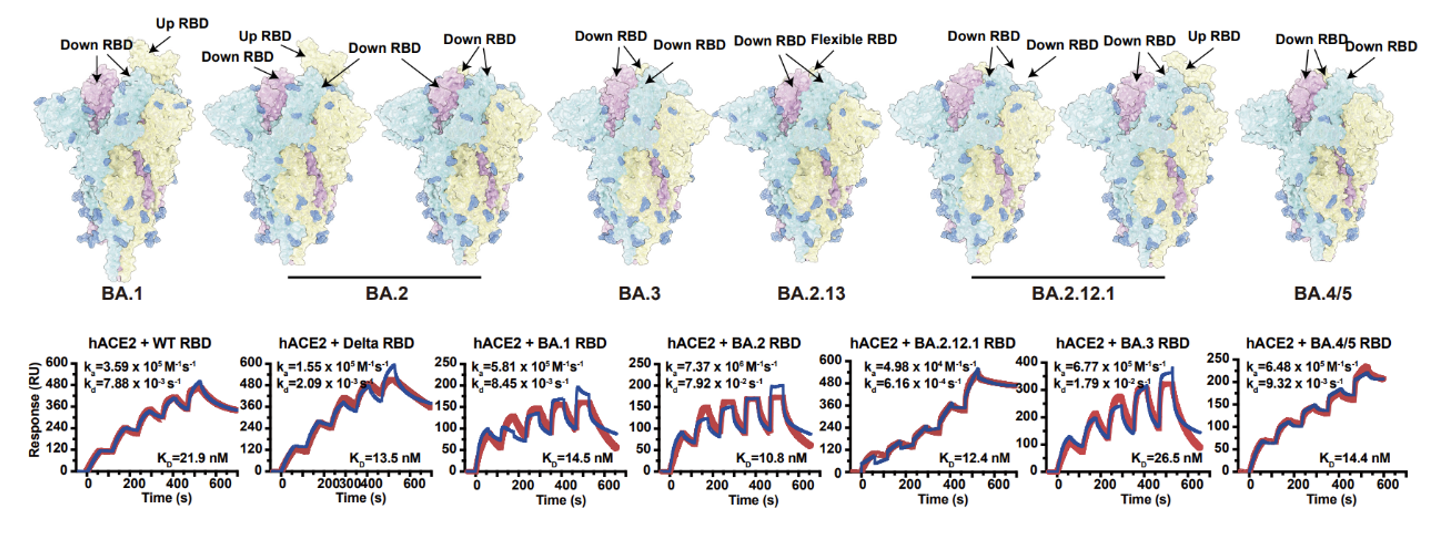
图1 奥密克戎各突变株Spike结构与RBD的hACE2亲和力
研究发现,接种三针疫苗人群的血浆对BA.2.12.1和 BA.4/5的中和能力相比BA.2有大幅下降,且BA.1突破感染的康复者血浆对BA.2.12.1和BA.4/5的中和能力也有明显下降。流式细胞分析和单细胞VDJ测序结果说明,BA.1突破感染主要唤起人体内接种疫苗后产生的对原始株的体液免疫记忆,由此诱发的抗体可以同时中和原始株和BA.1,但对新变体的广谱中和活性不佳,这符合“免疫原罪”理论,提示基于BA.1的奥密克戎疫苗难以对新的突变体提供广谱有效的预防能力,可能并不适合作为现有人群免疫背景下的加强针(图2)。
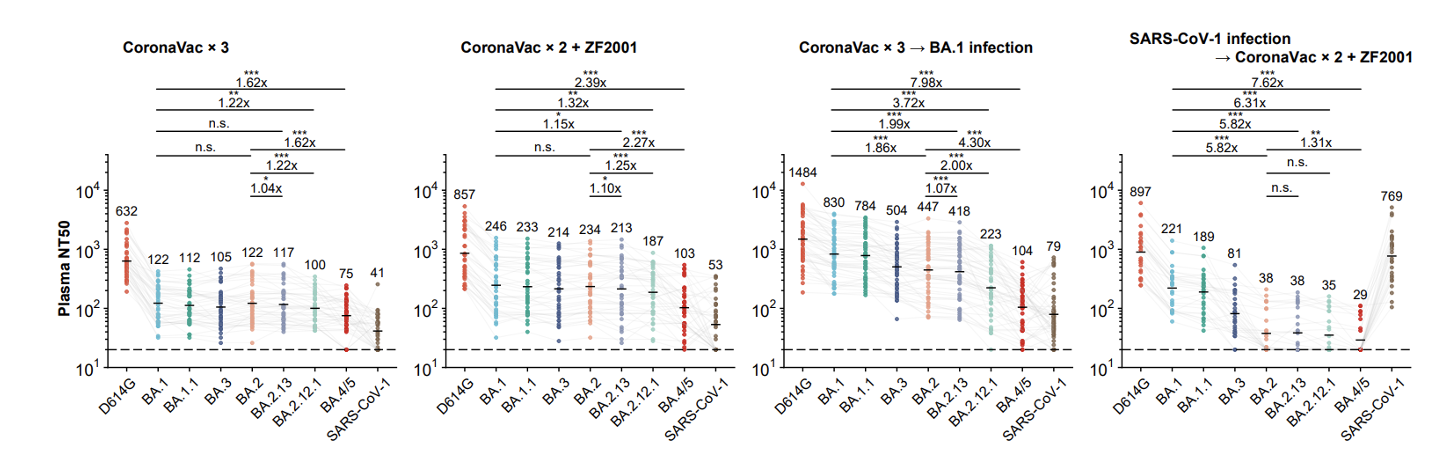
图2 疫苗接种者、BA.1突破感染康复者、接种疫苗的SARS康复者血浆对各毒株的中和活性
对抗体药物的研究也印证了奥密克戎株新亚型高度的中和抗体逃逸能力,多数现存抗体药物对奥密克戎中和活性大大下降。BA.2、BA.4和BA.5携带的S371F、D405N和R408S位点突变导致大部分乙型冠状病毒广谱抗体(如S309)失活,而LY-CoV1404(Bebtelovimab)和COV2-2130(Cilgavimab)仍然对BA.2.12.1和BA.4/BA.5保持中和活性。此外,团队筛选出了一对表位不冲突的广谱乙型冠状病毒中和抗体组合SA58和SA55,该抗体对能高效中和包括奥密克戎株新亚型在内所有流行过的突变株,以及非典病毒,RaTG13,Pangolin-GD等Sarbecovirus病毒,有望成为兼具强效预防和治疗效果的药物(图3)。
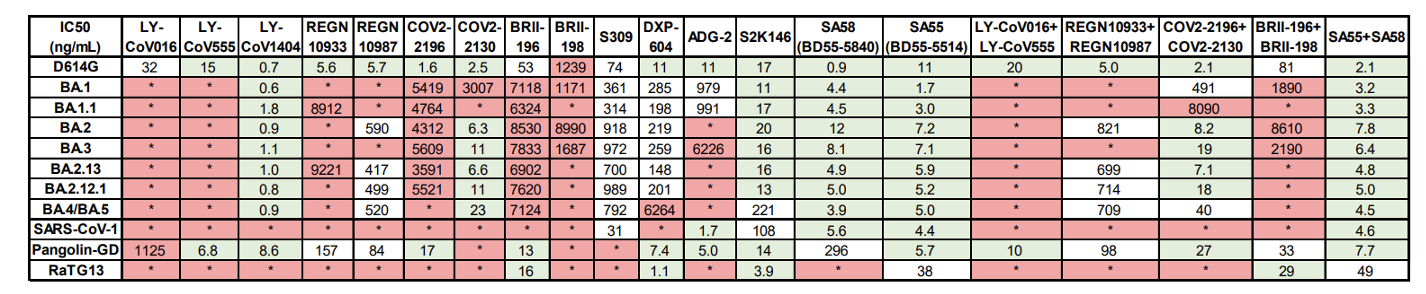
图3 现存抗体药物对各毒株的中和活性
为了进一步探究奥密克戎突变株的中和抗体逃避机制,团队利用高通量深度突变扫描技术确定了1640 个与RBD结合的抗体的逃逸图谱、表位分布和对奥密克戎株中和功效,其中614个和411个分别来源于BA.1 康复者血浆和接种新冠疫苗的SARS康复者血浆。通过对逃逸图谱的无监督聚类,抗体分为A、B、C、D1、D2、E1、E2.1、E2.2、E3、F1、F2、F3 12类,数据表明属于同一类内的抗体有相似的结合抗原和中和特征,各类抗体的主要逃逸位点与该类代表性抗体在复合物结构中的结合表位一致(图4)。
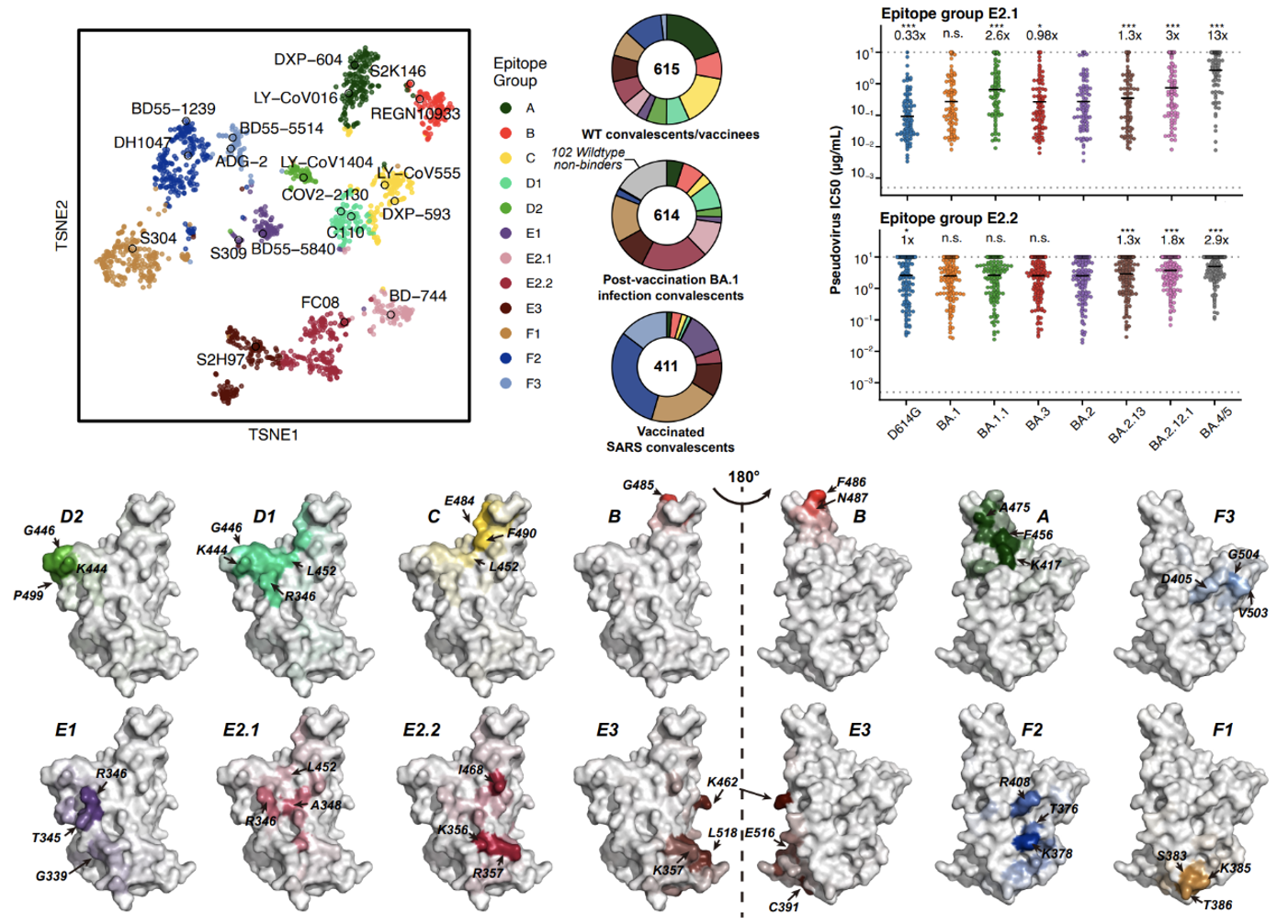
图4 原始株RBD抗体的表位分类及各类抗体特征
614个来自BA.1突破感染康复者血浆的抗体中包括512个原始株/BA.1 RBD交叉结合的抗体,以及102个仅结合BA.1 RBD的抗体。交叉结合抗体主要富集于E2.1、E2.2、E3、F1等非ACE2竞争表位,其中E3和F1类抗体的中和活性普遍较差,E2.2类抗体中和活性一般,E2.1类抗体虽有较好的中和活性,但受携带L452Q 的BA.2.12.1和携带L452R的BA.4/5的影响,中和活性降低。仅结合BA.1的抗体则几乎都与ACE2竞争,具体的结合位点与结合原始株RBD的抗体大不相同,这表明BA.1 RBD的抗原性相比原始株RBD有很大变化。同时,这部分抗体被BA.2和BA.2.12.1的D405N及BA.4/5的F486V/L452R严重逃逸。这些结果单个抗体水平解释了为何BA.1突破感染的康复者血浆被奥密克戎株新亚型逃逸(图4、图5)。
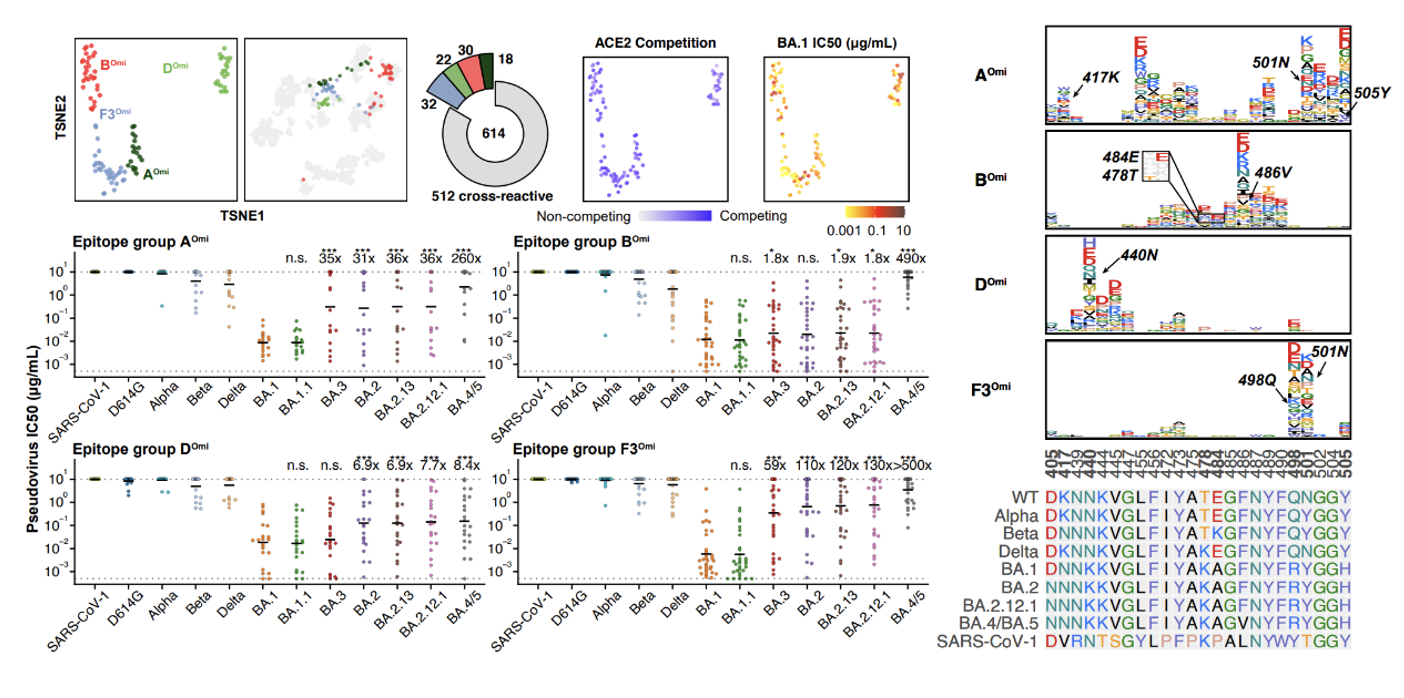
图5 BA.1 RBD特异性抗体的表位分类、中和活性及逃逸位点
假病毒中和实验和结构分析表明,SARS-CoV-1/2 RBD交叉结合的广谱中和抗体集中分布的表位(E1、F2、F3)也都受到BA.2、BA.2.12.1、BA.2.13和BA.4/5所携带的S371F、D405N、R408S突变的影响。其中E1类抗体由于S371F引起的局部构象变化导致亲和力下降,F2/F3类抗体多数被D405N和R408S突变逃逸。这表明乙型冠状病毒B支系(sarbecovirus)的广谱中和抗体也在很大程度上被奥密克戎BA.2、BA.2.12.1、BA.2.13和BA.4/5变异株逃逸(图6)。
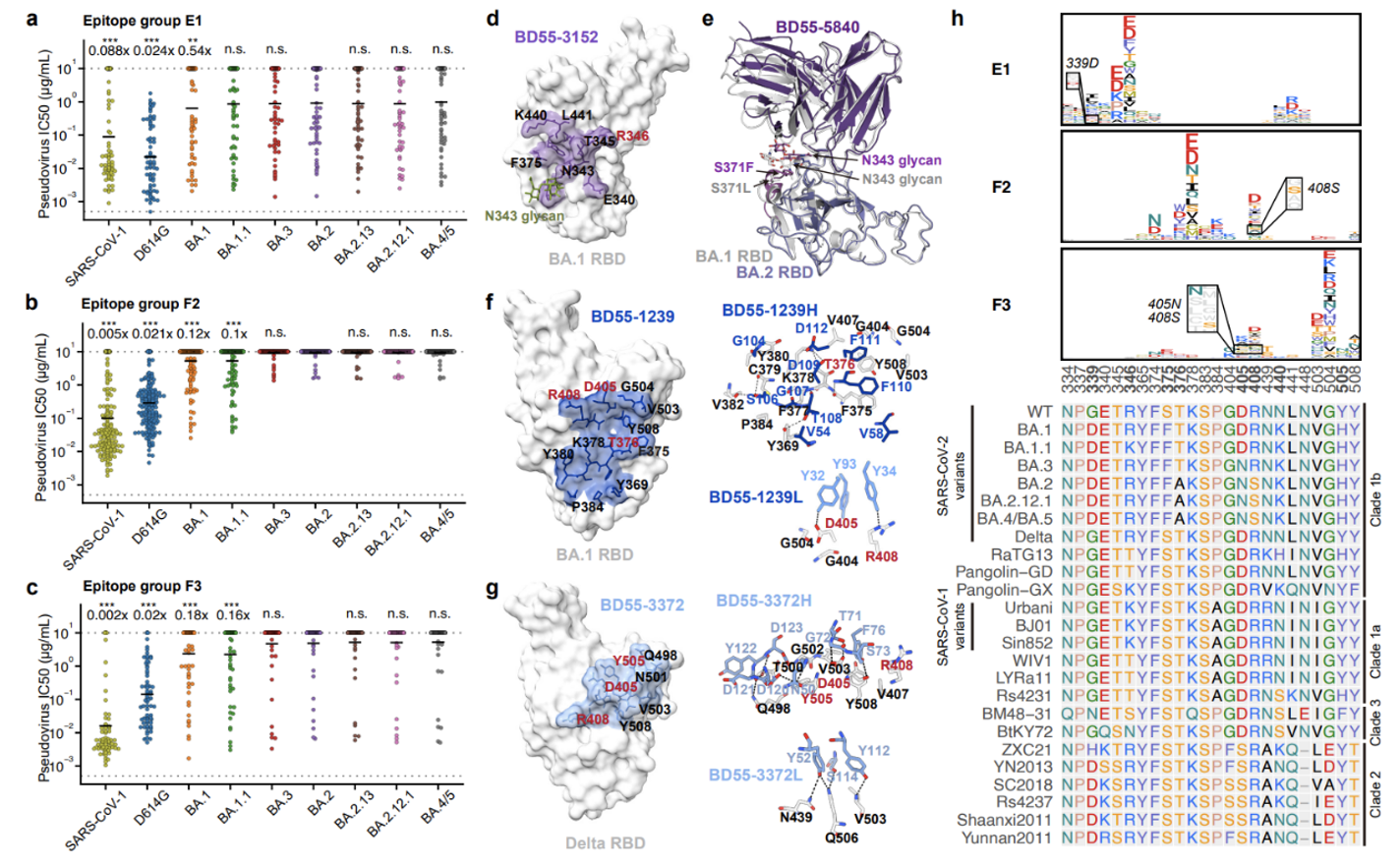
图6 乙型冠状病毒B支系广谱中和抗体的中和活性、结构特征及逃逸位点
本研究展示了联合高通量单细胞测序技术和高通量深度突变扫描技术在抗体筛选表征工作上的强大应用潜力,结合逃逸图谱聚类和各个表位代表性抗体的结构分析,成功在单个抗体水平上解析出奥密克戎BA.1株突破感染康复者血浆中抗体的表位分布,以及奥密克戎株新亚型逃逸各类中和抗体的物理化学机制,并构建出新冠病毒RBD抗体结合表位、逃逸图谱、中和活性的综合数据库,为后续抗体药物和广谱疫苗的研发提供数据支撑。
昌平实验室、北京大学生物医学前沿创新中心曹云龙副研究员,北京大学博士研究生阿依江·伊斯马衣、简繁冲、宋玮良、肖天贺、王菁,北京大学生命科学学院杜硕博士,中国科学院生物物理所王磊,中国食品药品检定研究院李倩倩、于原玲,南开大学陈筱素为本文的共同第一作者。昌平实验室、北京大学生物医学前沿创新中心谢晓亮教授、曹云龙研究员,北京大学生命科学学院、昌平实验室肖俊宇研究员,中国科学院生物物理所王祥喜研究员,中国食品药品检定研究院王佑春研究员,南开大学沈中阳教授为本文的共同通讯作者。本研究得到科技部昌平实验室基金支持。
论文链接:
https://www.nature.com/articles/s41586-022-04980-y

曹云龙,北京大学生物医学前沿创新中心(BIOPIC)副研究员。哈佛大学化学博士学位。新冠疫情期间利用单细胞基因组学技术在新冠蛋白特异性B细胞和抗体免疫方向做出突出研究贡献,以第一作者、共同通讯身份在Nature, Cell, Cell Research等杂志发表10余篇文章。相关新冠研究成果被评选为“2020年中国科学十大进展”。曾获得2021年度麻省理工科技评论“35岁以下科技创新35人”。

肖俊宇,结构生物学家,北京大学生命科学学院、北大清华生命科学联合中心研究员。2002年毕业于北京大学;2008年在密歇根大学获得理学博士学位;2009年到 2011年,在加州大学圣地亚哥分校做博士后,师从Jack Dixon教授;2011 年2013年,在加州大学圣地亚哥分校作为项目科学家开展研究工作;2014年到2019年在北京大学担任助理教授;2014至今,在北京大学生命科学学院担任研究员/独立PI;2020至今,担任北京大学长聘副教授。获国家自然科学基金委优秀青年科学基金、中源协和生命医学创新突破奖、顾孝诚讲座奖、药明康德生命化学研究杰出成就奖等奖励。

谢晓亮,生物物理化学家,北京大学李兆基讲席教授,单分子生物物理化学的奠基人之一、相干拉曼散射显微成像技术和单细胞基因组学的开拓者。谢晓亮团队发明的全基因组扩增技术已使数千个患有单基因遗传病的家庭成功避免了致病基因的后代传递。他是中国改革开放后大陆赴美学者中分别受聘哈佛大学终身教授(1999年)和讲席教授(2009年)的第一人,2018年全职回国工作,任北京大学生物医学前沿创新中心(BIOPIC)创始主任。他的学术荣誉包括美国生物医学最高奖之一“阿尔伯尼奖”、美国物理化学最高奖“Peter Debye奖”和美国生物物理最高奖”Founder 奖”。


