Nature Communications | 陈雷研究组报道NALCN-FAM155A亚通道复合体的高分辨结构
钠通道NALCN复合体主要位于神经元细胞膜上,介导了电压调控、胞外钙离子阻塞的钠漏电流,使静息电位偏向于去极化,从而提高神经细胞的兴奋性(1-4)。NALCN通道亚基在哺乳动物中高度保守,与电压门控钙离子通道(CaV)和电压门控钠离子通道(NaV)具有一定的同源性。NALCN的功能异常会导致多种严重的神经疾病(5),例如:患有精神运动发育迟缓和特征面相的小儿肌张力低下(IHPRF)(6,7)、四肢和面部先天性挛缩、肌张力低下和发育迟缓(CLIFAHDD)(8)等。除此之外,也有报道显示NALCN参与了呼吸节律(1)、痛觉感知(9)、生物钟(10)和快速动眼睡眠(11)等重要的生物学过程。
尽管NALCN通道有着如此重要的功能,但其工作机制仍不清楚。有报道显示在HEK293和爪蟾卵母细胞等异源体系中,只有共同表达NALCN、FAM155、UNC79和UNC80四个亚基,才能测量到典型的钠漏电流(2)。其中,NALCN是孔道形成亚基(1,2);FAM155是跨膜调控亚基,协助NALCN上膜(12);而UNC79和UNC80是分子量巨大(300 kD和370 kD)且功能尚不清楚的调控亚基(2,4)。
2020年12月3日,北京大学陈雷研究组在 Nature Communications 杂志上报导了哺乳动物NALCN-FAM155A亚通道复合体的高分辨结构。本项研究使用单颗粒冷冻电镜技术来探究NALCN的工作机制。由于NALCN-FAM155-UNC79-UNC80四元复合体不够稳定,作者在此聚焦于较稳定的NALCN-FAM155核心亚复合体的结构解析。经过同源蛋白筛选等步骤,作者确定以大鼠NALCN和小鼠FAM155A亚基组成的复合体为研究对象,并在克服了样品制备、数据处理等困难后,通过单颗粒冷冻电镜技术获得了2.65 Å高分辨率的NALCN-FAM155A复合体的电子密度,并根据同源蛋白结构搭建了原子模型。
结构显示NALCN整体结构与CaV和NaV的结构类似,由四个同源但不相同的重复结构域(DI-DIV)组成,每个重复含有6个跨膜螺旋(S1-S6),其中位于中心的S5-S6形成了孔道区,而位于四周的S1-S4组成了电压感受结构域(VSD)。胞外FAM155A的半胱氨酸富集结构域(CRD)像盖子一样盖在NALCN孔道结构域的顶端,并与NALCN的胞外loop有着复杂而紧密的相互作用。此外,NALCN的C端结构域(CTD)与III-IV螺旋(III-IV linker)及DII-DIII间的CTD相互作用螺旋(CIH)共同组成了胞内结构域(图1)。
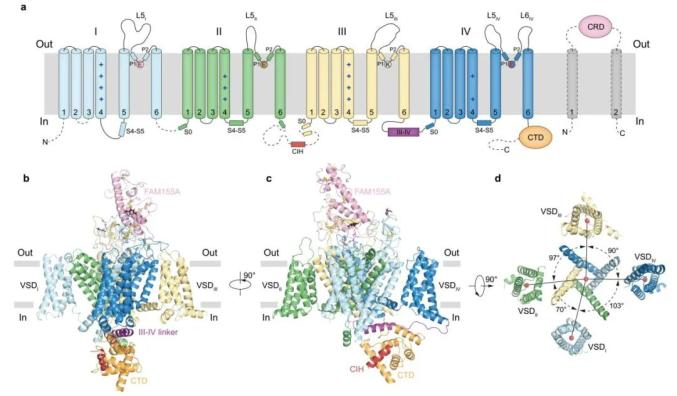
图1:NALCN-FAM155A亚复合体的结构
通过计算离子通过的路径,作者发现NALCN胞外孔道区周围的氨基酸带有较多负电,利于吸引胞外钠离子并排斥阴离子。而计算出的孔道半径显示孔道区在两个地方收缩的很紧,一个是靠近胞内的疏水的“门”,最小半径小于1 Å,表明通道处于关闭状态;另一个是靠近胞外的离子选择过滤器,负责选择性地通透钠离子。序列比对的结果显示NALCN的离子选择过滤器由“EEKE”组成,不同于NaV的“DEKA”和CaV1.1的“EEEE”。高分辨率的电子密度显示NALCN第四个结构域的选择过滤氨基酸E1389有两种构象,但均不位于选择过滤器的高场强(HFS)层,从而导致在HFS层,NALCN与NaV的电荷分布相似,均为− − + 0,这可能解释了NALCN为何对钠离子有更高的选择性(图2)。此外,有研究表明:相比于E1389,D1390对于胞外钙离子阻塞NALCN的电流更加重要2,这也与所观测到的结构相吻合。
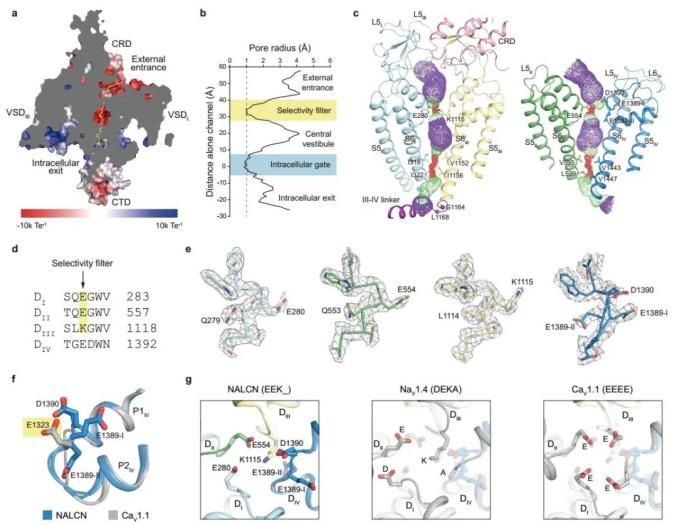
图2:NALCN孔道区的结构
NALCN通道复合体的电流也受到电压调控,其中电压感受结构域VSD扮演着重要角色。VSD发挥功能依赖于其内部的电荷转移中心(CTC)和S4上连续的带正电的氨基酸(R1-R6)。CTC主要由S2上一个芳香族氨基酸及间隔开的两个带负电的氨基酸(E1-F3-E4)和S3上相邻的负电氨基酸组成。相比NaV和CaV等电压门控离子通道,NALCN的VSD发生了不同程度的退化。根据序列比对和结构比较,可以发现NALCN的VSDI和VSDII有着完整的CTC和S4上的正电氨基酸簇;而VSDIII的CTC并不完整,缺少S2上关键的芳香族氨基酸;VSDIV虽然有着完整的CTC,但S4仅仅只有两个带正电的氨基酸(图3)。先前的研究结果表明VSDI和VSDII的S4上的正电氨基酸对于NALCN的活性至关重要,而VSDIII和VSDIV的S4上的正电氨基酸则可有可无2,这与所观测到的结构一致。
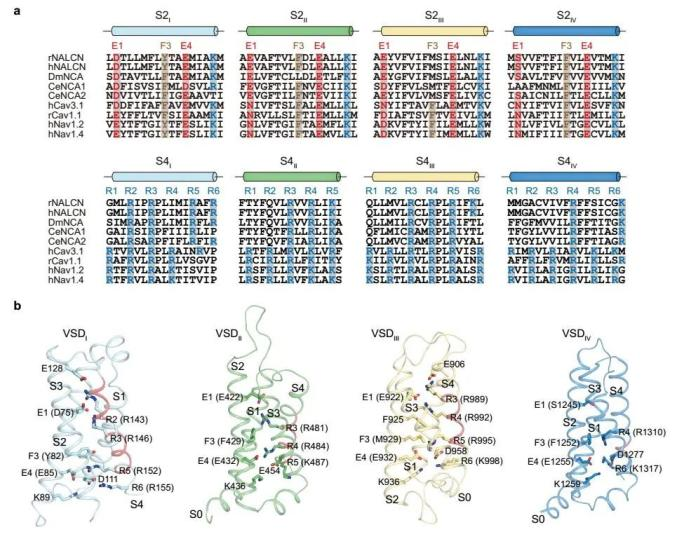
图3:NALCN电压感受结构域的结构
综上所述,本项研究通过结构生物学技术,观测到了哺乳动物NALCN-FAM155A亚复合体的高分辨结构,为深入理解NALCN的钠离子选择性、胞外钙离子阻塞和电压调节特性等奠定了基础。
在本项工作的撰写和投稿过程中,美国基因泰克公司研究组和西湖大学研究组分别在2020的Nature 13和Nature Communications 14杂志上报道了人源的NALCN-FAM155A亚复合体2.8 Å和3.1 Å的冷冻电镜结构。这些研究报道的结构与本研究在整体上相似,但本研究依据高质量的电子密度,发现了NALCN通道离子选择过滤器的新构象,并搭建了CTD互作螺旋(CIH)和更加完整的FAM155A的原子模型。
本项研究主要由北京大学未来技术学院分子医学所博士生康云路完成,博士后吴惊香参与了电镜数据收集的工作,陈雷研究员为通讯作者。陈雷实验室主要研究代谢类疾病和心血管疾病药物靶点的工作机制,长期招收对此方向感兴趣的博士生和博士后。本工作获得科技部重点研发计划、国家自然科学基金委、生命科学联合中心CLS和膜生物国家重点实验室的经费支持。博士后吴惊香获得了CLS博士后奖学金、北京大学博雅博士后奖学金、国家自然科学基金及中国博士后科学基金的支持。该工作的冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台上完成,得到了李雪梅、郭振玺、邵博、裴霞和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。本项研究得益于宾夕法尼亚大学Dejian Ren教授赠送的大鼠和人源NALCN、小鼠UNC79和UNC80的cDNA,美国西北大学Lear Bridget教授提供的果蝇UNC79和UNC80的cDNA,美国西北大学Ravi Allada教授提供的果蝇NCA和NLF-1的cDNA,日本国立遗传学研究所Yuji Kohara教授提供的线虫NCA1的cDNA。


