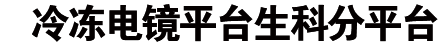Nature Communications | 陈雷组报道人源SGLT在转运葡萄糖循环中的结构变化过程
钠-葡萄糖共转运蛋白(SGLT)是一种葡萄糖的转运蛋白1,它们能够利用钠离子的电化学势梯度进行葡萄糖的逆浓度梯度转运1,并且在人体血糖水平的稳态调控中发挥关键作用。SGLT1和SGLT2是SGLT家族中最重要的两个葡萄糖转运蛋白。SGLT2由SLC5A2基因编码,主要在肾脏近曲小管S1和S2节段表达,负责原尿中90%的葡萄糖重吸收2,SGLT2的失活突变会导致家族性肾尿糖2,3;SGLT1由SLC5A1基因编码,主要在小肠和肾脏近曲小管S3节段表达4,负责肠道中及原尿中残余葡萄糖的重吸收5。SGLT1的失活突变会导致肠道葡萄糖-半乳糖吸收不良症1。
2021年12月份,北京大学未来技术学院分子医学研究所陈雷课题组报导了人源SGLT2-MAP17复合物与抑制剂恩格列净结合的结构6,同期美国斯坦福大学冯亮课题组也报导了人源SGLT1无配体结合状态的向内开放的结构7。2022年11月份,陈雷课题组报导了人源SGLT1-MAP17复合物与抑制剂LX2761结合状态的向外开放的结构8。但SGLT1/2蛋白双向关闭状态的结构并不清楚,而这一状态的结构对于进一步理解SGLT的转运过程有重要意义。
2023年5月22日,陈雷课题组在Nature Communications杂志发表了题为“Structures of human SGLT in the occluded state reveal conformational changes during sugar transport”的研究论文,该研究通过冷冻电镜单颗粒分析解析了人源SGLT1和SGLT2在底物结合状态及SGLT2在无底物结合状态下的结构。
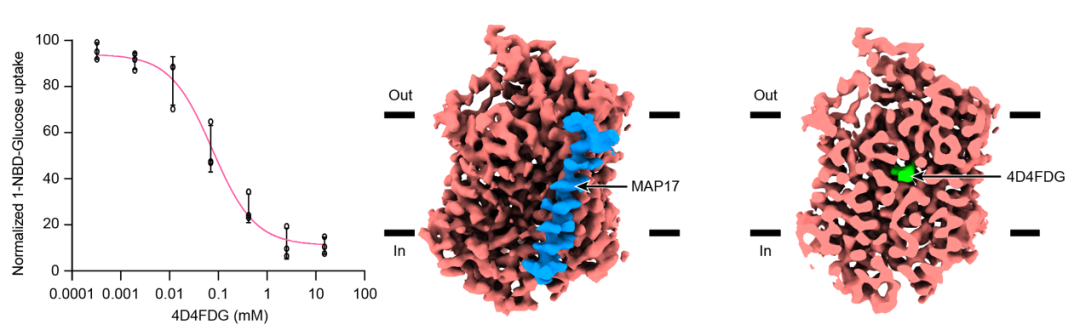 图1 SGLT1对4D4FDG的IC50曲线及hSGLT1-MAP17复合体的电子密度图
图1 SGLT1对4D4FDG的IC50曲线及hSGLT1-MAP17复合体的电子密度图
为了获得底物结合状态的SGLT1的结构,作者们首先测试了不同的底物,最后选择了高亲和力的4D4FDG。该底物是将葡萄糖的第四位羟基取代为氟原子,使得其对SGLT1的亲和力提高了约10倍9。作者们利用之前开发的“三接头策略”10 ,构建了人源SGLT1-MAP17复合体,利用冷冻电镜单颗粒技术解析了人源SGLT1-MAP17复合体在4D4FDG结合状态下的结构(图1)。
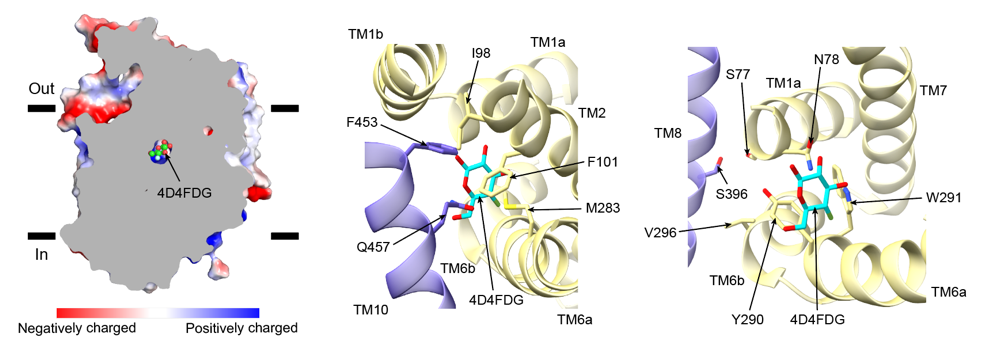
图2 底物4D4FDG将SGLT1固定在关闭构象
该结构显示结合底物状态的SGLT1处于双向关闭的构象,其转运通道的胞外侧和胞内侧的门控氨基酸相互靠近,将底物4D4FDG锁定在转运体内的空腔中(图2)。
结合之前发表的无配体结合状态的SGLT1结构(向内开放)和抑制剂LX2761结合状态(向外开放)的SGLT1结构,作者们将向内开放、关闭和向外开放的结构进行了比对,描绘了SGLT1在三种状态之间的构象变化。作者们发现有些螺旋发生了较大的构象变化,即TM0,3,4,5,8,9,10,这些螺旋被命名为变化区(moving region),其他螺旋的位置基本不发生变化,即TM1,2,6,7,11,12,13,作者把这些螺旋命名为较小运动区(less-mobile region)。在SGLT1由外向开放转变为关闭构象的过程中,F453氨基酸向内移动了约3.8Å,与I98和F101形成相互作用从而关闭外向开口。同时,TM4,9,10的转动使底物结合位点和钠离子结合位点更加稳定。在由关闭构象转变为内向开放的过程中,作者们发现TM5,8的向外运动带动TM3和10的移动,从而破坏了两个钠离子结合位点,扩大了底物结合位点的空腔,打开了胞内侧的开口,使得底物能够扩散进入细胞内(图3)。
图3 SGLT1在转运过程中的构象变化(上:从外向开口到关闭构象;下:从关闭构象
同时,作者们也解析了SGLT2-MAP17复合体在结合底物甲基葡萄糖(AMG)和未结合底物状态的结构。其中,结合底物AMG的状态与SGLT1结合4D4FDG的状态一致,均为关闭构象;未结合底物状态的SGLT2与SGLT1-APO的状态一致,都为内向开口的构象。根据结构比较和分析,作者们提出了SGLT在转运过程中螺旋变化的模型(图4)。
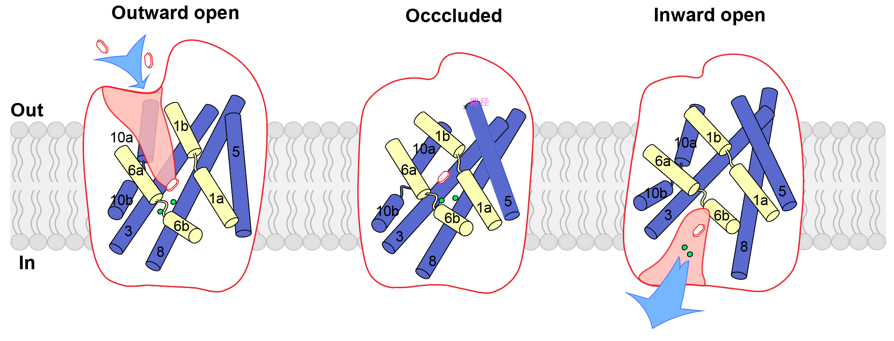
图4 SGLT转运过程中的螺旋变化模型
根据之前的研究,SGLT2在发挥功能时需要和MAP17组装成复合体,而SGLT1不需要MAP17的辅助就可以单独发挥功能。通过结构比对,作者们发现在不同的构象下MAP17与TM13的相对位置均未发生变化,因此MAP17可能不是通过参与转运循环的构象变化来发挥功能的。通过表面标记实验,作者们确定了MAP17对SGLT2的上膜有明显的促进作用。这表明MAP17对SGLT2发挥功能的重要作用是通过促进SGLT2上膜来进行的,这与此前基于荧光共聚焦显微镜的研究结果截然相反11(图5)。
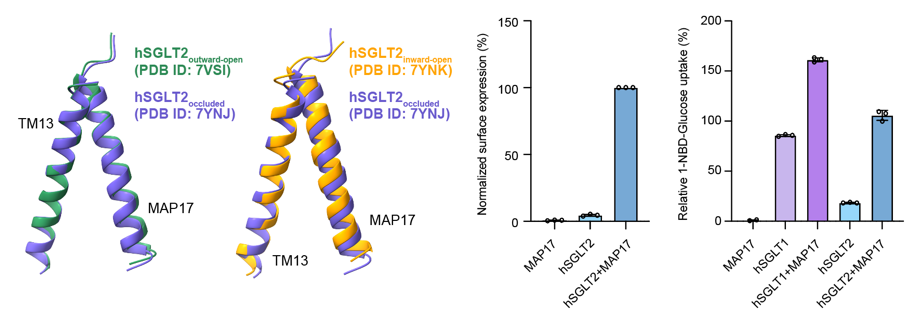
图5 SGLT2不同构象中MAP17的相对位置和表面标记
综上所述,作者通过冷冻电镜对SGLT1-MAP17, SGLT2-MAP17复合物和底物结合的结构和未结合底物的结构进行解析,发现底物将SGLT锁定在关闭状态,确定了SGLT1底物的结合位点,并描述了SGLT在转运底物过程中的构象变化,为进一步理解SGLT蛋白的转运过程和SGLT抑制剂的进一步优化提供了结构基础。
北京大学未来技术学院分子医学所博士研究生崔文浩和牛延革为本论文的共同第一作者,陈雷研究员为论文的通讯作者。该研究还得到陈雷课题组的博士生孙泽健,刘锐的大力协助。该工作冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台完成,得到了李雪梅、郭振玺、裴霞、惠小娟、秦昌东和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。该课题得到国家自然科学基金,国家科技部基金以及生命科学联合中心等经费支持。
文章链接:https://www.nature.com/articles/s41467-023-38720-1
参考文献