Nature Communications | 肖俊宇研究组发现恶性疟原虫演化出多种“劫持”IgM的分子机制
疟疾仍然是世界范围内的重要公共卫生问题。据世界卫生组织统计,2020年全球共计约有2.41亿人感染疟疾,造成约62.7万人死亡 [1]。疟疾是一种由疟原虫感染引起的寄生虫病,其中恶性疟原虫致死率最高。恶性疟原虫以裂殖子形式感染红细胞并在其中繁殖,最终导致红细胞的裂解,从而引起发热和溶血性贫血等临床症状。一些被感染的红细胞会黏附在胎盘或者大脑的内皮细胞上,引起胎型疟和脑型疟等危重症状。
抗体是人体免疫系统的核心组成部分,对抵御包括恶性疟原虫在内的多种病原体具有重要保护作用。其中,IgM型抗体是人体体液免疫反应的第一道防线,主要以五聚体的形式存在,包含十个抗原结合位点,能够高效地结合并中和病原体 [2-3]。此外,IgM还能有效的激活经典补体通路,在抵御疟疾的过程中发挥重要作用 [4]。北京大学肖俊宇研究组聚焦对IgM分子机制的研究,在之前工作中阐明了IgM五聚体组装和黏膜转运的机制、以及IgM被特异性受体识别的机制 [5, 6]。
在与人类长期的“军备竞赛”中,恶性疟原虫演化出了拮抗IgM的机制。例如,恶性疟原虫会表达一类被称为PfEMP1的毒力蛋白,并将其分泌至红细胞表面。这些蛋白分子量为250~350 kDa,有一个很大的胞外区,包含多个达菲样结构域(Duffy-binding-like domain, DBL),可以结合很多人体分子 [7]。例如,PfEMP1家族的VAR2CSA蛋白能够结合胎盘表面的硫酸软骨素,从而将感染的红细胞滞留于胎盘中的毛细血管,引起胎型疟 [8]。PfEMP1-TM284VAR1则能够显著引起红细胞的花簇状聚集(Rosetting),导致脑型疟 [9]。定位在恶性疟原虫裂殖子表面的DBLMSP蛋白家族成员也能够招募IgM并利用其逃逸人体的免疫攻击 [10]。对这些恶性疟原虫蛋白与IgM的互作机制之前还没有得到充分理解。
2023年5月8 日,北京大学肖俊宇课题组在Nature Communications期刊发表了题为“Plasmodium falciparum has evolved multiple mechanisms to hijack human immunoglobulin M”的研究成果,发现恶性疟原虫蛋白演化出了多种不同的IgM结合模式,为进一步理解恶性疟原虫的免疫逃逸机制提供了重要基础。
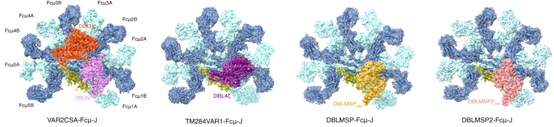
图1. 四种恶性疟原虫蛋白与IgM核心区形成复合体的冷冻电镜结构。
该研究体外纯化了VAR2CSA和TM284VAR1的胞外域,以及DBLMSP和DBLMSP2的DBL结构域,并将它们分别与IgM五聚体的核心区域组装成复合体,然后利用冷冻电镜技术解析了这些复合体的结构(图1)。结果显示,虽然这些恶性疟原虫蛋白均通过其DBL结构域与IgM的中心区结合,但它们与IgM的相互作用存在多种不同模式。VAR2CSA通过DBL3X和DBL5ε两个结构域同时与三个IgM-Fc(Fcμ)单元结合。DBL3X通过子结构域1(SD1)结合Fcμ2B链和Fcμ3B链,而DBL5ε则通过SD1与Fcμ1B和Fcμ2B相互作用。另一个PfEMP1蛋白TM284VAR1虽然也含有多个DBL结构域,但只利用其DBL4ζ结构域与IgM结合。与DBL3X和DBL5ε的结合模式不同,DBL4ζ通过子结构域SD1和SD2介导与Fcμ1B、Fcμ2A和Fcμ2B的相互作用。DBLMSP家族的两个蛋白DBLMSP和DBLMSP2则通过其DBL结构域中的三个子结构域SD1、SD2和SD3与Fcμ1A、Fcμ1B和Fcμ2B链结合,展示了另外两种不同的结合模式。
那么,恶性疟原虫是如何利用IgM来逃逸人体的免疫系统呢?根据结构研究和生化结果分析,可以将其免疫逃逸机制归纳为以下三个方面:首先,恶性疟原虫蛋白与IgM的结合区域是IgM受体分子(pIgR、FcμR等)相互作用的主要热点区域,因此恶性疟原虫蛋白与IgM的结合会干扰IgM与受体的结合,从而抑制相关的免疫信号通路。其次,IgM会遮盖许多已知的抗原表位,从而使恶性疟原虫蛋白逃逸人体IgG中和抗体的攻击。此外,由于空间位阻效应,与恶性疟原虫蛋白结合的IgM无法再与C1复合体结合、或者无法与抗原发生有效结合,从而阻碍IgM对经典补体途径的激活(图2)。
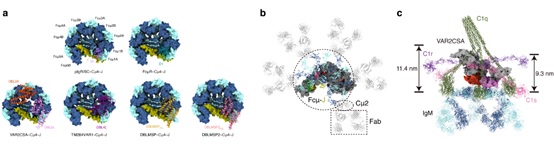
图2. 恶性疟原虫利用IgM介导免疫逃逸。
总之,这一工作厘清了恶性疟原虫蛋白与IgM相互作用的复杂分子机制。本应作为人体免疫系统攻击疟原虫有效武器的IgM,反而被恶性疟原虫的多个分子以不同方式“劫持”,充当了保护疟原虫的“盾牌”(图3)。
图3. IgM被恶性疟原虫蛋白劫持充当“盾牌”。
蛋白质与植物基因研究国家重点实验室、北京大学生命科学学院、北大清华生命科学联合中心肖俊宇研究员为该论文的通讯作者。北京大学博士后纪成功和生命科学学院19级博士生沈皓为该论文的共同第一作者。本研究得到了昌平实验室、北京大学生命科学学院启东产业创新基金和北京大学博雅博士后项目的支持。
原文链接:https://www.nature.com/articles/s41467-023-38320-z
参考文献:
1. World malaria report 2021. Geneva: World Health Organization (2021). Licence: CC BY-NC-SA 3.0 IGO.
2. Heyman, B. & Shulman, M. J. in Encyclopedia of Immunobiology (ed Michael J. H. Ratcliffe) 1-14 (Academic Press, 2016).
3. Keyt, B. A., Baliga, R., Sinclair, A. M., Carroll, S. F. & Peterson, M. S. Structure, Function, and Therapeutic Use of IgM Antibodies. Antibodies (Basel) 9, doi:10.3390/antib9040053 (2020).
4. Boyle, M. J. et al. IgM in human immunity to Plasmodium falciparum malaria. Sci Adv 5, eaax4489, doi:10.1126/sciadv.aax4489 (2019).
5. Li, Y. et al. Structural insights into immunoglobulin M. Science 367, 1014-1017, doi:10.1126/science.aaz5425 (2020).
6. Li, Y. et al. Immunoglobulin M perception by FcmuR. Nature 615, 907-912, doi:10.1038/s41586-023-05835-w (2023).
7. Wahlgren, M., Goel, S. & Akhouri, R. R. Variant surface antigens of Plasmodium falciparum and their roles in severe malaria. Nat Rev Microbiol 15, 479-491, doi:10.1038/nrmicro.2017.47 (2017).
8. Fried, M. & Duffy, P. E. Adherence of Plasmodium falciparum to chondroitin sulfate A in the human placenta. Science 272, 1502-1504, doi:10.1126/science.272.5267.1502 (1996).
9. Ghumra, A. et al. Identification of residues in the Cmu4 domain of polymeric IgM essential for interaction with Plasmodium falciparum erythrocyte membrane protein 1 (PfEMP1). J Immunol 181, 1988-2000,doi:10.4049/jimmunol.181.3.1988 (2008).
10. Crosnier, C. et al. Binding of Plasmodium falciparum Merozoite Surface Proteins DBLMSP and DBLMSP2 to Human Immunoglobulin M Is Conserved among Broadly Diverged Sequence Variants. J Biol Chem 291, 14285-14299, doi:10.1074/jbc.M116.722074 (2016).


