Nature Communications | 陈雷研究组报道UNC79-UNC80调控钠通道NALCN-FAM155A的结构机制
神经细胞的静息膜电位(Resting Membrane Potential, RMP)影响着神经细胞的可兴奋性,对于维持神经细胞正常的生理功能至关重要。钠漏通道NALCN(Sodium Leak Channel, Nonselective)介导了神经细胞的钠漏电流,能使静息膜电位更加去极化,从而提高神经细胞的可兴奋性1-4。NALCN在哺乳动物中高度保守,与电压门控钙离子通道(CaV)和电压门控钠离子通道(NaV)同源性较高。NALCN参与了诸多与神经系统相关的重要的生物学过程,包括呼吸节律的调节1、痛觉感知5、生物钟的调节6和快速动眼睡眠7等。在人群中,NALCN的单点突变就会引起多种严重的神经发育遗传疾病,包括精神运动发育迟缓和具有特征面相的小儿肌张力低下症(IHPRF)8,9,以及四肢和面部先天性挛缩、肌张力低下和发育迟缓症(CLIFAHDD)10等。尽管NALCN通道有着如此重要的功能,但其工作机制仍不清楚。有报道显示在HEK293细胞和爪蟾卵母细胞等异源体系中,只有共同表达NALCN,FAM155,UNC79和UNC80四个亚基,才能测量到明显并且典型的钠漏电流4。其中,NALCN是孔道形成亚基;FAM155是跨膜胞外调控亚基11,协助NALCN上膜;而UNC79和UNC80是分子量巨大(300 kDa和370 kDa),且不与任何已知蛋白具有序列同源性的胞质调控亚基3。
2022年5月12日,北京大学未来技术学院分子医学研究所、生命科学联合中心、国家生物医学成像中心陈雷研究组在Nature Communications 杂志上报道NALCN-FAM155A-UNC79-UNC80复合物的冷冻电镜结构及UNC79-UNC80调节NALCN-FAM155A的机制(http://dx.doi.org/10.1038/s41467-022-30403-7)。
陈雷研究组在2020年曾报道过NALCN-FAM155A亚复合体的高分辨率结构12,阐明了NALCN的钠离子选择性、胞外钙离子阻塞和电压调节特性的结构基础,发现了在NALCN通道中独有的位于II-III linker上的CIH螺旋结合在CTD上。但是UNC79和UNC80的结构以及它们是如何激活NALCN的并不清楚。本项研究主要使用结构生物学及电生理的手段,来探究UNC79和UNC80是如何激活NALCN的。先前的研究表明,UNC79和UNC80容易与NALCN-FAM155A亚复合体发生解离,因此,作者们在NALCN的C末端融合了GFP,UNC80的N末端融合了与GFP高亲和力结合的纳米抗体以稳定UNC79/80与NALCN间的相互作用。经过同源蛋白筛选等步骤,作者们确定以大鼠NALCN和小鼠FAM155A, UNC79和UNC80亚基组成的复合体为研究对象,并在克服了样品制备、数据处理等困难后,通过单颗粒冷冻电镜技术获得了整体分辨率为3.2 Å的四元复合物的电子密度,并搭建了准确的原子模型。结构显示UNC79和UNC80均由富含螺旋的结构组成,这些螺旋进一步的组装成HEAT重复或ARM重复等超螺旋结构。UNC79的N端与UNC80的C端、UNC79与UNC80的中间铰链区以及UNC79的C端与UNC80的N端均存在着紧密的相互作用,形成钳子状的复合体,整体形状类似于无穷号“∞”(图1)。除了HEAT重复和ARM重复外,UNC80含有一个类泛素结构域,并且UNC79和UNC80的还各含有一个锌指结构域。NALCN-FAM155A亚复合体位于UNC79和UNC80的中间铰链区的上方,并且NALCN的跨膜区以及胞质C端结构域(CTD)并不直接与UNC79和UNC80发生相互作用。NALCN主要是通过胞内loop区与UNC79-UNC80发生相互作用的:NALCN胞质侧的I-II linker中的一段β-发卡结构(UNIM-A)与UNC79发生相互作用,II-III linker中的一段loop-螺旋结构(UNIM-B)以及一段L型螺旋结构(UNIM-C)与UNC80发生相互作用(图1)。作者们将NALCN与UNC79/80发生相互作用的基序命名为UNC Interacting Motif (UNIM)。
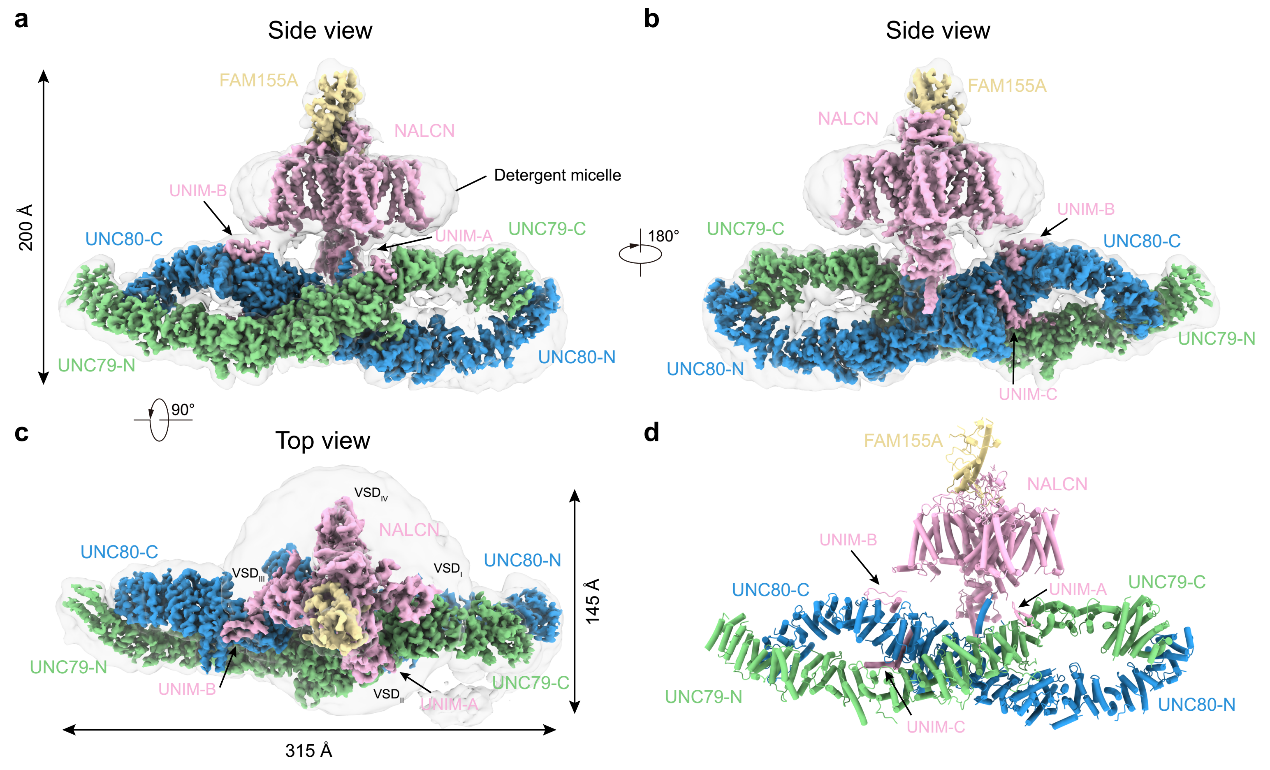
图1 NALCN-FAM155A-UNC79-UNC80复合体的结构
随后作者们基于该结构研究了UNC79和UNC80是如何调控NALCN活性的,发现UNC79, UNC80和FAM155A三个附属亚基对于NALCN能够正确的转运到细胞膜上是必不可少的。当突变UNIM-A或UNIM-B以破坏UNIM-A或UNIM-B与UNC79/80的相互作用后,能够正确转运到细胞膜上的NALCN变得很少,钠漏电流也变得很小,表明UNIM-A和UNIM-B与UNC79/80之间的互作对于NALCN能够正确转运到细胞膜上是必不可少的。这有可能是因为这些互作使UNC79/80遮挡了NALCN胞质侧loop上的内质网滞留信号,从而促进NALCN上膜(图2)。
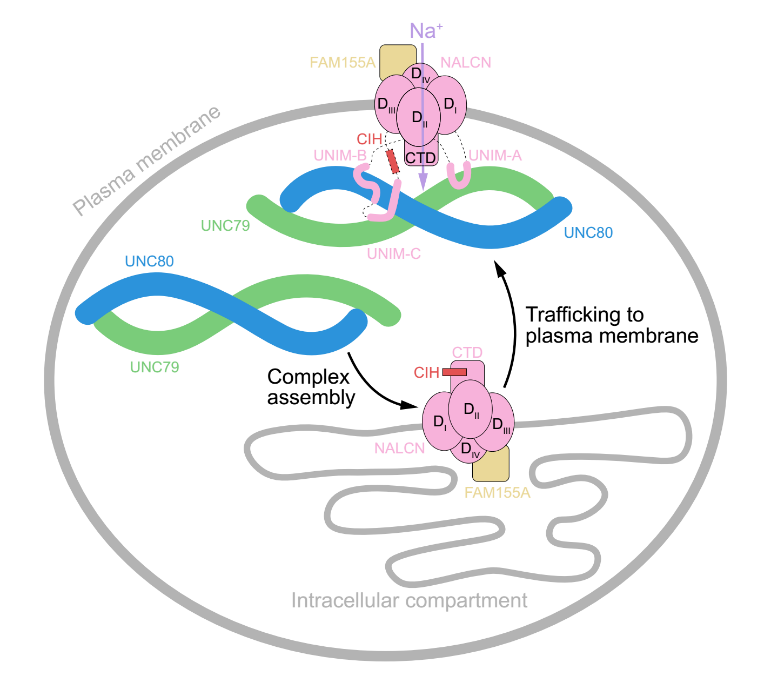
图2 UNC79-UNC80激活NALCN的机制的示意图
与UNIM-A和UNIM-B不同的是,当突变UNIM-C以破坏UNIM-C与UNC79/80的相互作用后,NALCN的上膜和钠漏电流的大小均不受影响,但NALCN更难以被电压激活,电导-电压曲线(G-V curve)发生明显右移。作者们发现UNIM-C与UNC80的互作会牵引II-III linker中原本结合在NALCN的CTD上的一段螺旋(CTD Interacting Helix, CIH)与CTD发生解离,从而解除CIH的自抑制作用,激活NALCN(图2)。
该项研究在2021年12月 21日即公布在预印本BioRxiv上(https://doi.org/10.1101/2021.12.20.473568)。在2021年12月美国基因泰克公司的Jian Payandeh研究组和2022年4月西湖大学的闫浈研究组分别在Nature13和Cell Discovery14杂志上也报道了人源的NALCN-FAM155A-UNC79-UNC80复合体的冷冻电镜结构。与其这些研究相比,本研究观察到的结构整体相似,并且通过功能实验阐明了UNC79-UNC80是如何通过促进NALCN上膜以及解除CIH自抑制作用来激活NALCN的,为深入理解NALCN复合体的工作机制奠定了基础。
本项研究第一作者为陈雷课题组博士后康云路,陈雷研究员为第二作者兼通讯作者。本工作获得科技部重点研发计划、国家自然科学基金委、生命科学联合中心、千人计划的经费支持。博士后康云路获得了北京大学博雅博士后奖学金的支持。该工作的冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台上完成,得到了李雪梅、郭振玺、秦昌东、裴霞和王国鹏等人的帮助。该项目的数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。宾夕法尼亚大学Dejian Ren教授提供了大鼠和人源NALCN,小鼠UNC79和UNC80的cDNA。


