2024年8月14日,中国医学科学院药物研究所天然药物及核药基础与新药创制全国重点实验室吴惊香团队在国际顶级期刊Nature在线发表题为“Substrate binding and inhibition mechanism of norepinephrine transporter”的研究论文。该研究解析了关键的神经系统疾病靶标——人源去甲肾上腺素转运体(Norepinephrine transporter, hNET)三个不同功能状态下的高分辨率结构,揭示了其底物识别及抑制作用机制,为以NET为靶标的药物研发提供了结构基础。中国医学科学院药物研究所是论文的唯一通讯单位。

随着现代社会生活节奏加快和竞争压力增大,很多现代人陷入了压力山大、焦虑、抑郁、多动、亢奋等精神障碍困境中。这些精神障碍都与一个共同的因素相关,那就是去甲肾上腺素。去甲肾上腺素在机体处于应激状态时被释放,为“战或逃”做准备,帮助机体渡过难关,是重要的神经递质和激素。NET能将释放的去甲肾上腺素再摄取回神经细胞突触前端,控制去甲肾上腺素信号的强度和持续时间。NET异常与诸多疾病相关,是重要的成像及治疗靶标。目前,NET底物类似物被广泛用来诊断和治疗多种神经内分泌肿瘤、以及心脏病和帕金森病的诊断;NET抑制剂也用于治疗多动症、焦虑和抑郁、神经退行性疾病和药物上瘾滥用等疾病。因此,阐明NET的底物转运机制以及药物抑制机制是该领域结构药理学的核心问题。
该研究发现无底物结合状态的hNET处于向内开口的构象,
胞外门控处的氨基酸形成了多样的电荷互作和氢键网络,使其关闭。MIBG是去甲肾上腺素的一种合成胍乙啶类似物。核素标记的[123I]MIBG是交感神经系统放射性成像的金标准,能诊断和治疗多种神经内分泌肿瘤。该研究发现MIBG-结合状态的hNET同样处于向内开口的构象,MIBG稳定地结合在底物结合口袋中心,通过氢键以及疏水作用等与hNET的A, B, C三个亚位点的氨基酸发生广泛的相互作用。Radafaxine是安非他酮的活性代谢物,安非他酮可用来帮助戒烟和作为非典型抗抑郁药,是近几年来最常见的处方药之一。该研究发现radafaxine-结合状态的hNET也处于向内开口的构象,radafaxine占据了hNET的底物结合位点,与周围氨基酸形成π-π,氢键以及疏水互作,表明其是以正构抑制剂的形式发挥作用。
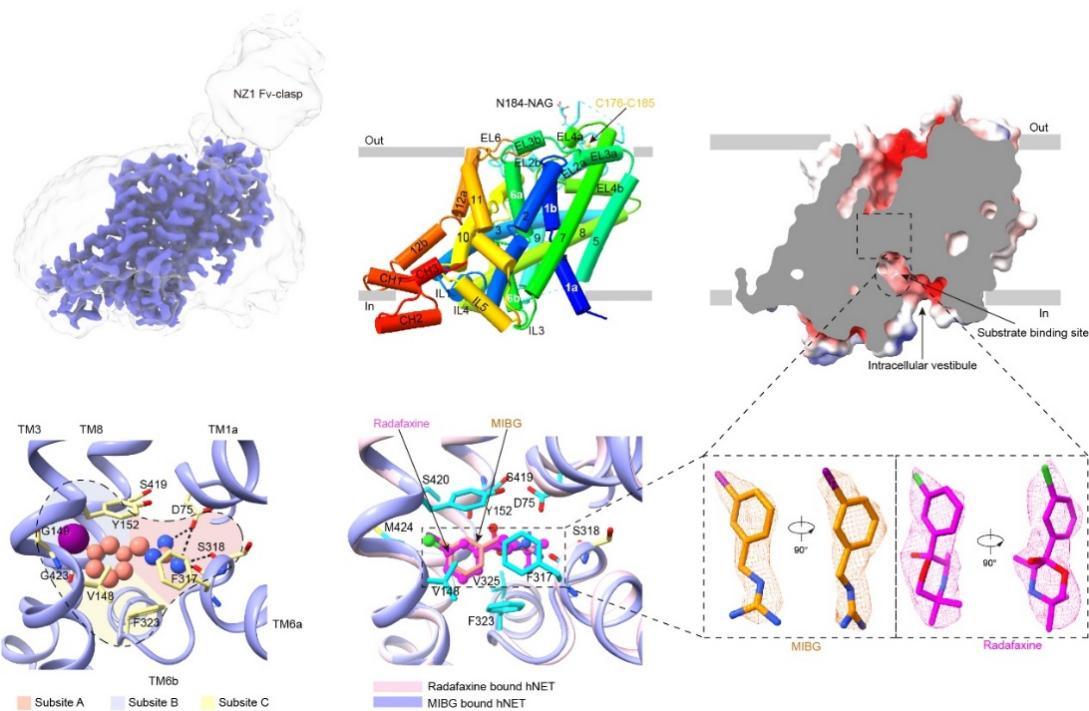
图 hNET三种功能状态代表性结构、特征以及MIBG和radafaxine结合位点比较
该研究得到国家自然科学基金(32371266)和中国医学科学院中央级公益性科研院所基本科研业务费(2022-RC350-01)基金的资助。
助理教授吴惊香研究员是2022年中国医学科学院药物研究所引进人才,为该论文的唯一通讯作者,研究生纪文明、缪安然,助理研究员梁凯以及研究生刘佳萌为本文的共同第一作者。药物所王锐院士、崔冰研究员、李平平研究员、刘陆平研究员、汪小涧研究员以及生物分析中心为该工作提供了支持和帮助。
2019年以来,在中国医学科学院北京协和医学院统一部署和大力支持下,药物研究所全面实施准聘长聘教职改革制度,从美国、德国、瑞士、日本、新加坡、中国等海内外著名高校、研究机构引进高层次人才15人,为新药研发事业不断注入新活力、激发新潜能。随着人才制度的红利进一步释放,药物研究所将继续全方位培养、引进、用好人才,推进科学研究、成果转化、新药研发等各项工作不断迈向新台阶、取得新成果。

论文链接:
https://www.nature.com/articles/s41586-024-07810-5





