Journal of Molecular Biology|陈雷课题组开发基于4F短肽解析真核膜蛋白结构技术
膜蛋白是生物膜功能的主要承担者,对信号转导、物质运输和酶催化等多种生物过程的进行至关重要。通过结构研究可深入揭示这些蛋白质的作用机制。传统的研究方法主要通过去垢剂从天然膜环境中剥离靶蛋白 1,然后通过X射线晶体衍射或冷冻电镜单颗粒分析等技术解析其结构。但确定合适的去垢剂来有效溶解和稳定每种特定的膜蛋白需要摸索 2,而且因去垢剂溶解导致的天然脂质缺失也可能会使某些膜蛋白的功能发生改变 3。因此,不依赖去垢剂的膜蛋白提取的技术已成为当前最具前景的替代方案之一,例如利用苯乙烯-马来酸聚合物(SMA)4,修饰或者未修饰的两亲性短肽等代替去垢剂来提取膜蛋白 5,6。然而,目前尚不清楚未经修饰的肽是否可以有效地提取真核细胞膜蛋白用于结构研究。
2025年10月6日,北京大学未来技术学院分子医学研究所陈雷课题组在Journal of Molecular Biology杂志上发表了题为“Unveiling eukaryotic membrane proteins in high resolution using peptide solubilization”的研究论文(https://doi.org/10.1016/j.jmb.2025.169467),证明了未修饰的短肽4F(序列:DWFKAFYDKVAEKFKEAF)可以将真核膜蛋白溶解成纳米级的盘状颗粒——4F-disc。以人源TRPC3通道为例,用4F提取的蛋白还可以转化为MSP包裹的纳米盘(Nanodisc),以便高分辨率结构的研究。(图1)
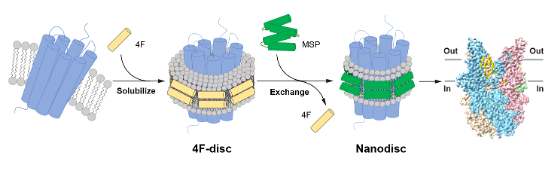
图 1, 4F-disc转化为Nanodisc过程的示意图
在细胞膜溶解测试中,4F肽表现出优良的特性。4F不仅能有效提取多种真核细胞膜蛋白,包括离子通道(TRPC3),氧化还原酶(DUOX1-DUOXA1、NOX2-p22)和转运蛋白(URAT1、NTCP),同时保留了其结构完整性和活性。(图2)
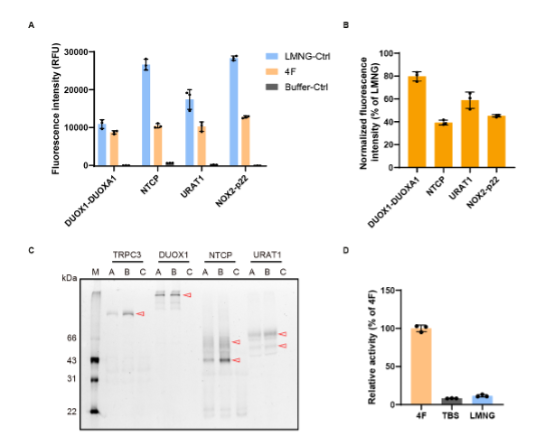
图 2, 4F肽提取真核细胞膜上的各类蛋白
为进一步验证用4F提取的蛋白解析结构的可行性,作者以人源TRPC3为例,将4F肽提取出的蛋白经亲和层析纯化,与过量的MSP孵育后得到大小合适的颗粒,并解析出了2.72 Å的TRPC3冷冻电镜结构。此结构与之前在去垢剂中解析的结构整体相同 7。在该电子密度中,除了众多的脂质密度以外,Pre-S1 elbow的N端和跨膜螺旋S1之间有一团非蛋白密度,可能是与TRPC3共纯化的内源性配体。相比之下,先前的研究由于提取蛋白时使用了去垢剂月桂基麦芽糖新戊二醇(LMNG)和胆固醇琥珀酸单酯(CHS),此处被CHS的占据,形成了非天然密度(图3)。
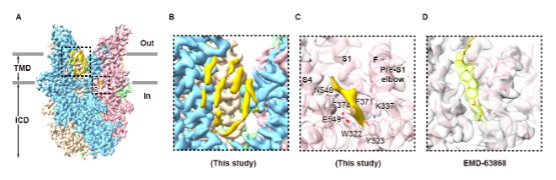
图 3, 由4F-disc转化为nanodisc的人源TRPC3的冷冻电镜结构
综上所述,本研究开发了使用4F肽提取真核细胞膜蛋白并进行结构解析的方法。这种方法避免了传统使用去垢剂纯化膜蛋白可能存在的缺陷,并可用于多种真核膜蛋白及其复合物,能够提供高分辨率结构信息,且可能为蛋白保留天然的脂质环境。这些发现揭示了短肽在膜蛋白研究中广泛的应用潜力,为理解完整真核膜蛋白的结构和功能提供了新的途径。
北京大学未来技术学院博士研究生臧佳和为本文的第一作者,陈雷研究员为通讯作者。该研究还得到陈雷课题组的博士后郭文君,博士生时亦廷、陶薇羽、刘啸宇的协助。实验中用到的SMA2000由曾欣博士合成。动态光散射和负染色电子显微镜相关工作在国家蛋白质科学基础设施北京基地北京大学分设施蛋白核心支撑平台完成。冷冻电镜数据在北京大学冷冻电镜平台完成采集,得到了工作人员李雪梅、郭振玺、秦昌东和王国鹏等人的支持。该项目的部分数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。本研究得到国家自然科学基金、北大-清华生命科学联合中心等经费支持。
参考文献
1 Kalipatnapu, S. & Chattopadhyay, A. Membrane protein solubilization: recent advances and challenges in solubilization of serotonin1A receptors. IUBMB Life 57, 505-512 (2005). https://doi.org:10.1080/15216540500167237
2 Lenoir, G. et al. Screening of Detergents for Stabilization of Functional Membrane Proteins. Curr Protoc Protein Sci 93, e59 (2018). https://doi.org:10.1002/cpps.59
3 Seddon, A. M., Curnow, P. & Booth, P. J. Membrane proteins, lipids and detergents: not just a soap opera. Biochim. Biophys. Acta 1666, 105-117 (2004). https://doi.org:10.1016/j.bbamem.2004.04.011
4 Lee, S. C. et al. A method for detergent-free isolation of membrane proteins in their local lipid environment. Nat. Protoc. 11, 1149-1162 (2016). https://doi.org:10.1038/nprot.2016.070
5 Ren, Q. et al. DeFrND: detergent-free reconstitution into native nanodiscs with designer membrane scaffold peptides. Nat Commun 16, 7973 (2025). https://doi.org:10.1038/s41467-025-63275-8
6 Kariyazono, H. et al. Formation of stable nanodiscs by bihelical apolipoprotein A-I mimetic peptide. J Pept Sci 22, 116-122 (2016). https://doi.org:10.1002/psc.2847
7 Guo, W., Tang, Q., Wei, M., Kang, Y., Wu, J. X. & Chen, L. Structural mechanism of human TRPC3 and TRPC6 channel regulation by their intracellular calcium-binding sites. Neuron 110, 1023-1035 e1025 (2022). https://doi.org:10.1016/j.neuron.2021.12.023


