Structure | 汪涛课题组报道人源IGF-1R与泛素拟素化修饰研究进展
2020年4月,汪涛课题组在《细胞》杂志(Cell)子刊《结构》(Structure)在线发表了题为“Visualization of ligand-bound ectodomain assembly in the full-length human IGF-1 receptor by Cryo-EM single-particle analysis”的论文,在本论文中,课题组利用冷冻电镜单颗粒重组技术解析了全长人源胰岛素样生长因子1受体(IGF-1R)与胰岛素、胰岛素样生长因子-1(IGF-1)的复合物结构。
IGF-1R和胰岛素受体(Insulin receptor,IR)都属于酪氨酸激酶(TK)受体,是位于人细胞表面的跨膜蛋白,在序列同源性和结构方面有很多相似之处,能够和胰岛素、IGF-1和IGF-2等重要激素结合,进而向细胞内传递信号,它们在细胞生长,分化和代谢,尤其是血糖调控方面发挥着非常重要的生物学功能,是癌症和糖尿病治疗的重要靶点。
自20世纪70年代以来陆续鉴定出胰岛素受体与胰岛素样生长因子受体,在过去数十年里全世界有几十个课题组尝试进行IGF-1R和IR结构解析,希望通过结构生物学研究解释其信号传导机制,但是迄今为止这两种受体的完整结构和信号转导机制尚不清楚。由于这两种蛋白都属于单次跨膜蛋白,具有数十个糖基化、磷酸化、二硫键等修饰,体外获得具有生物活性的蛋白样品难度很大,两个受体均具有很大的结构柔性与构象变化特性,因此成为结构生物学领域最具挑战的课题之一。
汪涛课题组构建了能够表达全长IGF-1R的HEK293T稳定细胞系,所得到的样品为完全不带有突变的天然状态且均具有体外生物活性,最终利用冷冻电镜技术重构了分辨率为4.7Å的IGF-1R/胰岛素复合物结构和7.7Å 的IGF-1R/IGF-1复合物结构(图1)。
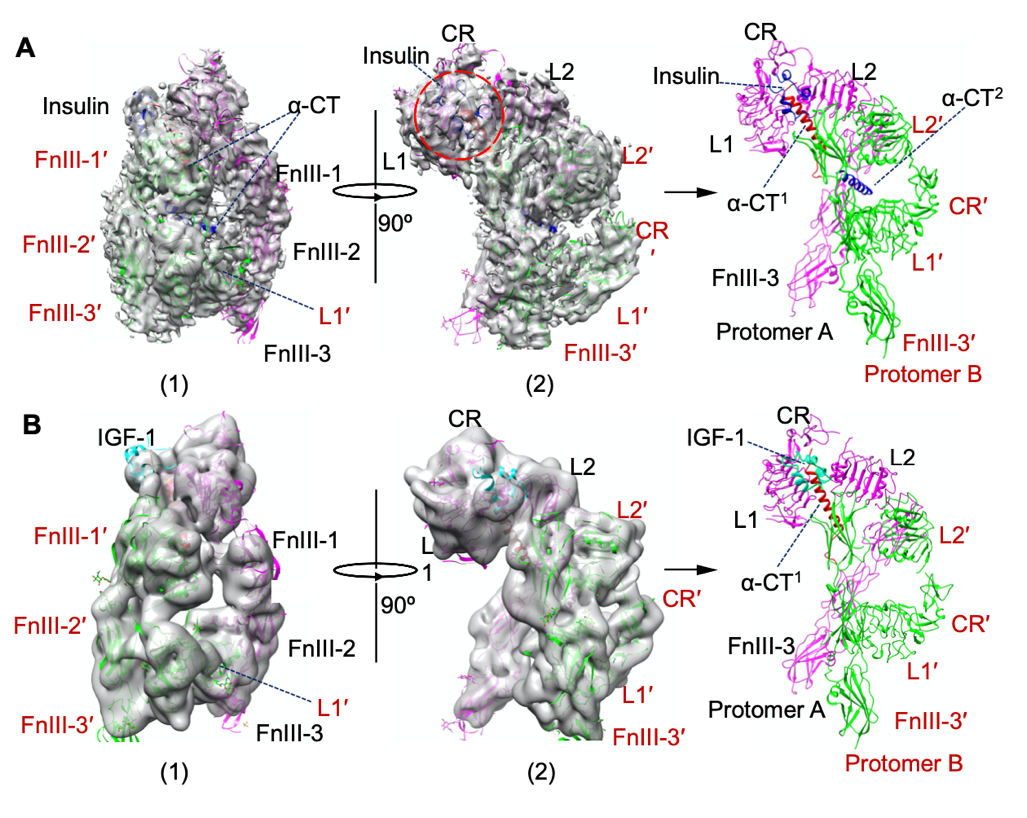
图1. 人源IGF-1R与胰岛素及IGF-1复合物冷冻电镜结构(A:IGF-1R结合胰岛素,B:IGF-1R结合IGF-1)
研究表明在全长人源胰岛素样生长因子1受体(IGF-1R)结构中,与以往文献认识的不同,在我们的结构中发现只有一个胰岛素或一个IGF-1分子与全长人IGF-1R受体结合,同时IGF-1R在结合激素配体后结构与构象发生了巨大改变,这与以往推测的IGF-1R受体识别激活机制完全不同。根据以往的研究文献报道,人胰岛素受体IR能结合1个胰岛素、2个胰岛素及4个胰岛素分子,我们的研究成果表明IGF-1R和IR具有明显的区别,这一研究成果为IGF-1R和IR激活与信号转导机制的阐明提供了重要线索和新的模型(图2)。
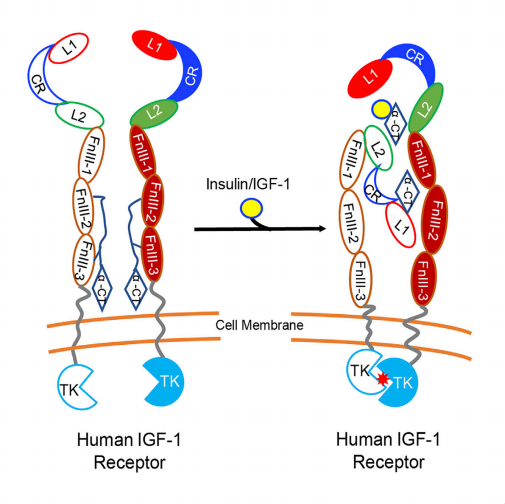
图2. IGF-1R结合1个激素分子并引发结构改变
2020年3月,汪涛课题组与南方科技大学生物系饶枫课题组合作,在美国科学院院刊PNAS在线发表题为“Basis for metabolite-dependent Cullin RING ligase deneddylation by the COP9 Signalosome”的共同通讯作者论文,在本工作中,作者利用生物化学、结构生物学、化学生物学及遗传学等多种研究手段,揭示了代谢小分子六磷酸肌醇(IP6)作为分子“胶水”促进CRL-CSN复合物组装和Cullin去拟素化的功能、机制和进化保守性。
泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质降解的主要途径,参与细胞内80%以上蛋白质的降解。该系统包括泛素、泛素活化酶E1,泛素结合酶E2,泛素连接酶E3,26S蛋白酶体和泛素解离酶DUBs。其中E3泛素连接酶决定底物特异性。最大类的E3是CRL泛素连接酶(Cullin RING E3 Ligases),CRL介导了总泛素化的20%,是潜在的肿瘤治疗重要靶点。
CRL泛素连接酶受拟素化修饰(Neddylation)动态调控。COP9 Signalosome(CSN)特异催化CRL的去拟素化(deneddylation)。CRL-CSN复合物的组装和解离动态调控具有复杂的机制,同时IP6作为CRL和CSN之间分子“胶水”的作用尚不清楚。
汪涛课题组创造性的利用T4溶菌酶辅助晶体生长的方法成功解析了IP6-CSN2复合物的高分辨率(2.5Å)晶体结构,在CSN2蛋白里清晰的看到IP6小分子电子云和结合模式,同时研究团队利用所解析的晶体结构对CRL4-CSN复合物的冷冻电镜(Cryo-EM)结构进行装配,意外发现了和IP6完美匹配的电子云,并鉴定出Rbx1上的K25/26残基和IP6直接互作,通过生化及功能研究也证实了相关作用关系,据此研究团队提出IP6是广谱的CRL-CSN分子间胶水的假设,并进行了体内和体外实验验证。这些结果阐明了IP6调控CRL-CSN复合体组装的机理,暗示IP6小分子的代谢是复合物解离的调控路径(图3)。
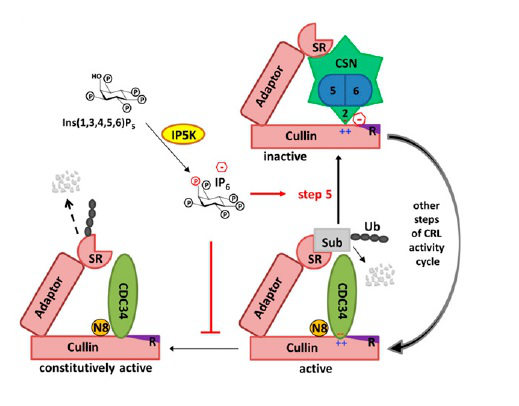
图3. (上) IP6-CSN2复合物的高分辨率晶体结构(下)代谢小分子IP6动态调控CRL泛素连接酶去拟素化的示意图
这项研究成果从分子水平阐释了IP6-CSN-CRL三元复合物的形成机制,在CRL-CSN的作用界面发现了一个小分子结合口袋,为靶向CRL提供了新思路。鉴于CRL的拟素化抑制剂MLN4924已是治疗癌症的三期临床药物,文章发表后引起了学术界的极大重视,PNAS对文章进行了特别评论,Faculty of 1000也认为其具有特殊意义(special significance)并对文章进行了特别推荐。
汪涛简介
科技部重大科学研究计划项目首席科学家(全国首批19项青年项目之一,蛋白质研究),深圳市孔雀计划海外高层次人才、广东省青年拔尖人才和广东省高等学校优秀青年教师。中国分子生物物理学会理事,作为负责人累计获得超过十多项国家、省、市级竞争性项目经费。主要研究方向为分子生物物理,综合利用X射线晶体学、冷冻电镜、分子生物学等手段解决生物学问题,从事膜蛋白的结构与功能研究以及重大疾病相关信号通路的结构生物学研究,同时进行药物靶标筛选及分子药物研究。以第一作者与通讯作者共在Nature、Nat Struct Mol Biol.、Structure、JBC等期刊发表论文二十余篇。研究工作多次得到国际科学媒体报道和关注,因工作出色2010年被Brookhaven National Laboratory授予 Spotlight Award,关于结核杆菌的研究成果被评为2010 年美国布鲁克海文国家实验室5大科学发现之一。关于细胞周期激酶PLK1的研究成果得到多家网络媒体报道并获2013年Nature Asia热点推荐。
论文链接:https://www.cell.com/structure/fulltext/S0969-2126(20)30079-4


