Nature Communications | 陈雷课题组发现SUR2A上的R螺旋抑制了KATP通道的激活
2023年6月17日,北京大学未来技术学院分子医学研究所、北大-清华生命科学联合中心陈雷课题组在Nature Communications杂志上发表了题为“The inhibition mechanism of the SUR2A-containing KATP channel by a regulatory helix”的论文。该研究通过解析SUR2A和SUR2B在抑制剂瑞格列奈(RPG)和不同Mg-核苷酸存在的条件下的一系列冷冻电镜结构,发现了SUR2A上存在的一段此前从未被报道过的可以抑制KATP通道的螺旋,链接见:https://www.nature.com/articles/s41467-023-39379-4。
KATP (ATP敏感的钾离子通道) 的活性被细胞内ATP抑制,被Mg-ADP激活。它们可以将细胞的能量代谢水平与细胞电信号偶联1。KATP通道是由四个Kir6亚基及四个SUR亚基组成的异源八聚体。其中Kir6亚基形成了钾离子外流的中心孔道区2,SUR亚基作为调节型亚基通过结合激活剂(Mg-ADP,KATP开放剂)和抑制剂(胰岛素促泌剂)来调控通道开关3。SUR亚基共有三种亚型,SUR1,SUR2A和SUR2B,其中SUR2A和SUR2B是由ABCC9基因编码的不同剪接体,仅C末端42个氨基酸存在差异1。SUR2A在心肌和骨骼肌中发挥重要作用,SUR2B主要分布于平滑肌2,4。ABCC9基因发生突变导致扩张型心肌病5、家族性房颤6、Cantu综合征7等疾病的发生。SUR蛋白属于ABC超家族,含有两个跨膜区(Transmembrane domain ,TMD)和两个胞内核苷酸结合结构域(Nucleotide-binding domain ,NBD)3,NBD二聚化促进TMD1和TMD2的靠近8。尽管不同的SUR亚基具有较高的序列相似性,Mg-ADP和KATP开放剂对不同亚型激活效果不同:相比于SUR1和SUR2B,SUR2A对Mg-ADP的激活响应明显较弱9-17。SUR2A的这种特性保证了心肌细胞在正常工作时不会导致KATP通道的激活,以避免其对心脏正常电信号的影响。陈雷课题组此前已经解析了SUR2A和SUR2B在NBD1结合Mg-ATP,NBD2结合Mg-ADP的occluded(OD)状态下的结构(SUR2OD/ATP/ADP)18。但这些结构并无法解释SUR2A对Mg-ADP激活作用的响应为何比其它SUR弱。
在此项研究中,陈雷课题组使用RPG抑制了SUR从Inward-facing (IF)构象向OD构象的完全转变,解析了一系列SUR2A和SUR2B在有Mg-核苷酸存在情况下的结构。研究者在NBD1和NBD2结合Mg-ATP的SUR2A(SUR2AIF/MgATP/MgATP)结构中观察到一段清晰的螺旋密度(924-942),这段螺旋与NBD1相连,结合于NBD1和NBD2之间,因此将其命名为调节螺旋(R螺旋)。R螺旋一侧通过R930和L933与NBD1上D789以及L792,L793和I806组成的疏水口袋相互作用,另一侧通过Y938,K931和R935与NBD2上结合的ATP相互作用。但研究者在NBD2结合Mg-ADP状态下的结构里(SUR2AIF/MgATP/MgADP),发现NBD产生了一定程度的相互靠近,而且未观察到R螺旋,表明Mg-ADP破坏了R螺旋与NBD的相互作用(图1)。
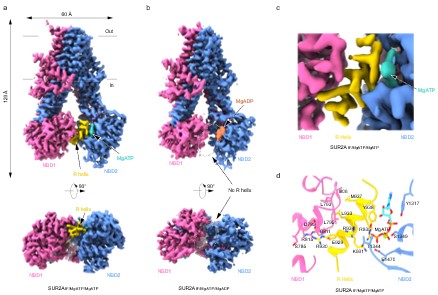
图1 不同核苷酸结合状态下SUR2A中R螺旋的电子密度
研究者在Mg-ATP结合状态下的SUR2B结构中同样观察到了R螺旋的密度,但其密度较差,说明其动态性较高。在NBD2结合Mg-ADP时,SUR2B主要呈现出两种构象,其中SUR2BIF/MgATP/MgADP类似于SUR2AIF/MgATP/MgADP,R螺旋密度模糊且不连续;另一种状态下SUR2BIF/MgATP/MgADP 的NBD更加相互靠近,R螺旋密度完全消失(图2)。
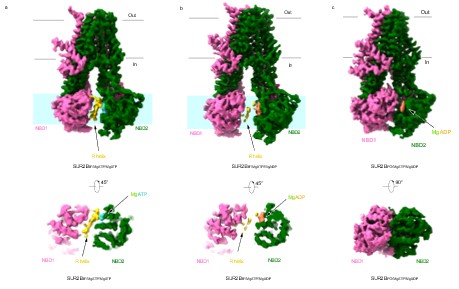
图2 不同核苷酸结合状态下SUR2B的构象及R螺旋的电子密度
研究者通过突变体的电生理功能实验发现:将SUR2A的R螺旋上与NBD1 和NBD2 相互作用的氨基酸突变会导致Mg-ADP对KATP通道的激活增强,说明R螺旋对KATP通道起抑制作用,这和其独特的空间位置相一致。
综上,该研究阐明了R螺旋通过抑制SUR2A的NBD二聚化来抑制KATP通道的结构机制(图3),提出了SUR2B-C42可能通过别构作用促进Mg-ADP与NBD2的结合,进一步导致R螺旋的解离和NBD二聚化以及KATP通道的激活。这项工作为进一步深入研究不同亚型KATP通道的调控机制打下了基础。
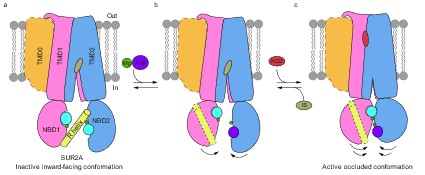
图3 R螺旋参与调节SUR2A蛋白构象变化的结构模型
北京大学前沿交叉学科研究院、北大-清华生命科学联合中心博士研究生丁典和侯天一为本项工作的共同第一作者。北京大学未来技术学院分子医学研究所博士后吴惊香和博士研究生韦淼在数据收集方面给予了帮助,陈雷研究员为论文通讯作者。该研究的冷冻电镜样品制备、筛选和采集在北京大学冷冻电镜平台和北京大学电镜室完成,得到了李雪梅、郭振玺、秦昌东、裴霞、惠小娟和王国鹏等人的大力协助,数据处理获得了北京大学CLS计算平台及未名超算平台的硬件和技术支持。该课题得到国家自然科学基金委、生命科学联合中心和膜生物学国家重点实验室的经费支持。


