Science | 生命科学学院肖俊宇研究组解析人源免疫球蛋白M复合体的高分辨率电镜结构
免疫球蛋白M(IgM)是人体内五类免疫球蛋白之一,在免疫系统中发挥重要功能。IgM以多聚体的形式存在,而多聚体的形成对IgM黏附病原生物、激活补体系统等功能都具有重要意义。在J链(J-chain)存在的情况下,IgM形成稳定五聚体。J链于1970年被发现,在脊椎动物中高度保守,但与其他已知结构蛋白相比没有同源性。它也参与调控IgA二聚体的形成。更为重要的是,它还在IgA/IgM的黏膜转运过程中扮演重要角色。黏膜覆盖人体的消化系统、呼吸系统、泌尿生殖系统等,是人体免疫系统的第一道防线。成年人体内的黏膜面积可达400平方米。分泌型IgA/IgM是黏膜防御系统中的主要抗体分子。由浆细胞分泌的IgA和IgM经由胞移作用(Transcytosis)穿越黏膜上皮细胞到达黏膜表面。这一过程需要J链的存在,还依赖于一个关键的受体蛋白:多聚免疫球蛋白受体(polymeric immunoglobulin receptor, pIgR)。pIgR在上皮细胞的基侧膜一侧特异结合含有J链的分泌型IgA和IgM分子,然后将它们转运至黏膜侧。在那里,pIgR经由蛋白酶的切割形成游离的分泌组份(secretory component, SC)并与IgA/IgM共同分泌(1-5)。虽然这些内容已经是免疫学教科书里的经典内容,但很多科学问题还没有得到清晰的理解,包括IgM五聚体的组装模式、J链发挥功能的分子机制、以及pIgR特异识别分泌型IgA/IgM的机制等。
2020年2月6日,北京大学生命科学学院肖俊宇研究组在Science杂志在线发表题为“Structural insights into immunoglobulin M”的研究论文,首次报道了人源IgM-Fc(Fcm)五聚体/J链/分泌组份三元复合体整体分辨率为3.4 Å的冷冻电镜结构(图)。包括IgM-Cμ4结构域、J链、pIgR/SC-D1结构域等在内的中心区域分辨率达到3.0 Å以下,可以清晰看到关键氨基酸的侧链信息。
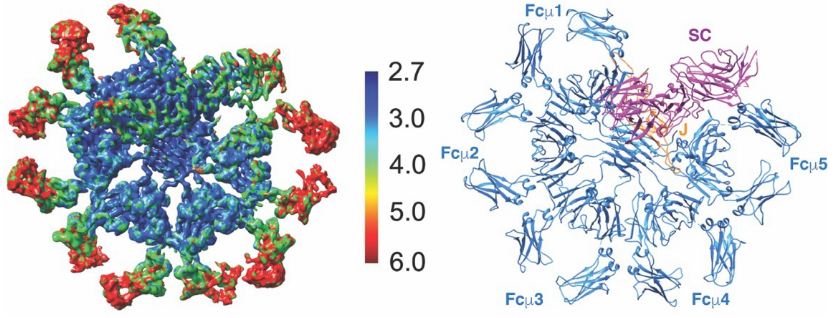
人源IgM-Fc/J链/分泌组份复合体的冷冻电镜结构
结构分析显示,区别于教科书中传统以来描述的五角星形状,IgM-Fc采用非对称的方式形成五聚体,整体形状类似于缺少了一个角的六边形。IgM-Fc羧基端的tailpiece通过致密的疏水相互作用紧密组装在一起,形成五聚体的中心。J链伸展开来形成两个“翅膀”状的结构,填补于IgM-Fc五聚体的缺口处。同时,J链也介导了IgM-Fc与pIgR/SC之间的相互作用。结合了IgM的pIgR/SC与apo状态相比发生很大的构象变化。进一步结构分析发现,pIgR/SC主要通过其D1结构域与IgM-Fc五聚体/J链相互作用,作者也通过生化手段对这些结构分析结果进行了验证。
这一工作颠覆了对IgM五聚体的传统理解,阐明了J链发挥功能的结构基础,并揭示了pIgR特异性识别包括IgM在内的多聚抗体的分子机制。该研究为深入理解IgM的生物学功能奠定了基础,也为基于IgM抗体的药物设计提供了重要参考。
Science杂志还同时在线发表了来自Genentech公司关于分泌型IgA的结构研究,与本研究成果相互映衬,互为补充。
蛋白质与植物基因研究国家重点实验室、北京大学生命科学学院、北大清华生命科学联合中心肖俊宇研究员为该论文的通讯作者。北京大学2015级博士研究生(PTN项目)李雅鑫和生命学院电镜平台王国鹏为该论文的共同第一作者。北京大学生命学院的高宁教授对该研究进行了重要指导。北京大学苏晓东教授以及李宁宁副研究员、朱秦毓、王禹心、褚华瑞,还有北京大学第一医院肾内科的于峰医生、谭颖医生、吴文君同学也参与了此项研究工作。研究得到了国家重点研发计划、国家自然科学基金委、北京大学临床+X项目、北京大学生命科学学院启东产业创新基金的经费资助。北京大学冷冻电镜平台和高性能计算平台对数据的收集和处理给予了大力支持。
文章来自:北京大学新闻网


