Cell Reports | 李龙课题组揭示磷脂转运蛋白flippase在细胞膜中的动态变化
2022年3月15日,北京大学生命科学学院李龙课题组在《Cell Reports》杂志,发表一篇题为 Conformational changes of a phosphatidylcholine flippase in lipid membranes的研究论文。该论文报道了磷脂转运酶(lipid flippase)在不同脂膜中的构象变化,首次发现该蛋白家族的静息状态,为理解细胞膜非对称性的形成提供了重要的分子基础。

真核细胞的细胞膜中,双分子层中的磷脂分子呈非对称分布:不同的磷脂分子根据其头部基团的性质不同,被选择性地富集于细胞质一侧或者细胞外一侧。这种非对称分布是细胞众多生理反应的基础。例如,促使细胞膜弯曲,开启细胞膜分泌途径;促进血液凝固、调控细胞凋亡、以及介导宿主细胞和病毒的相互作用等众多生理过程。本篇论文的研究对象,磷脂转运酶,是一类多次跨膜的四型P-type ATPases (P4-ATPases)。在ATP水解的驱动下,可以选择性地将不同的磷脂分子从细胞膜外侧转运至内侧,从而调控和维持细胞膜的非对称性。之前已报道的P4-ATPase家族的蛋白结构都是在去垢剂(detergent)环境中获得的。考虑到P4-ATPase与磷脂双分子层的紧密联系,李龙课题组利用脂纳米盘(lipid nanodisc)技术,将P4-ATPase重构到磷脂双分子层环境中,利用结构生物学和生物化学等技术手段探究其工作机理。
作者以酵母中选择性转运磷脂酰胆碱(phosphatidylcholine)的P4-ATPase,Dnf1蛋白,为代表性研究对象, 将其放入含有酵母天然脂分子组分的纳米盘中,利用冷冻电镜解析其结构,发现了一种在整个P-type ATPase家族中都未曾报道过的蛋白构象。在这种构象中,Dnf1跨膜区中的脂分子转运沟被破坏,很可能失去了转运脂分子的能力。化学交联实验显示该构象在细胞中广泛存在。细胞荧光流式分析证实,当Dnf1被锁在这个构象时,细胞转运磷脂酰胆碱的效率显著降低。因此这种新的构象很可能代表Dnf1在细胞中的静息状态。接下来,作者改变纳米盘中的磷脂组分,利用冷冻电镜单颗粒分析发现, 当转运底物磷脂酰胆碱在脂膜中的比例降低时, Dnf1自发地发生重大构象变化,恢复到活性状态,跨膜区的脂分子转运沟重新形成。这一系列实验揭示Dnf1可以感知细胞膜磷脂双分子层的组分变化,改变构象以满足磷脂转运的需要。细胞膜的磷脂组分与磷脂转运酶的活性存在互相影响调节的精巧关系(图1)。
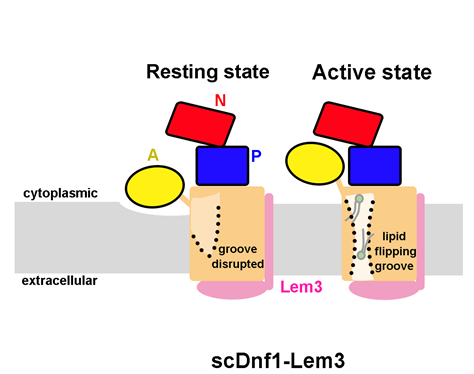
图1. Dnf1-Lem3复合物工作调控模型。
李龙研究员为该论文的通讯作者,博士后许金坤为该论文的第一作者,博士生何以琳全程参与各项实验,做出重要贡献,吴晓飞参与了冷冻电镜样品制备和数据收集。感谢生科院冷冻电镜平台,特别是王国鹏博士在数据收集方面提供的帮助,感谢凤凰工程吕红霞博士在流式分析中提供的支持。生科院蛋白平台提供了诸多仪器和技术支持。该项研究得到了北大清华生命科学联合中心,膜生物学国家重点实验室、国家自然科学基金、中国博士后科学基金和中心博士后基金经费支持。
文章来自:北京大学新闻网


